Introduzione
Gli anziani molto spesso soffrono contemporaneamente di problematiche dolorose sia acute che croniche, ma l’attenzione della ricerca e della clinica che viene rivolta alla valutazione del dolore nella popolazione geriatrica è relativamente modesta, rispetto a quanto avviene invece per la popolazione in generale (1). Il dolore è una delle manifestazioni sintomatologiche più frequenti nei pazienti anziani e specialmente nelle sue accezioni croniche esso diventa una “malattia” di per sé, spesso definita come tale alla stregua di una co-morbidità. Le stime prevalenti indicano che circa il 60% degli anziani sul territorio, fino all’80% degli anziani residenti in strutture di lungodegenza, è affetto da “dolore” (2,3).
La gestione del dolore nella popolazione geriatrica rappresenta una vera sfida a causa di aspetti legati alle co-morbidità, alla polifarmacoterapia e soprattutto al coesistere di disturbi cognitivi. La valutazione del dolore nella popolazione anziana richiede la misurazione dell’intensità del dolore, dell’efficacia degli oppioidi, nonché l’evidenziazione dell’impatto del dolore, rispettivamente sulla sfera psicologica, sociale, spirituale ed esistenziale del paziente sofferente (4). Le conseguenze del dolore non trattato possono modificare profondamente la qualità di vita dell’anziano, poiché oltre alle modificazioni fisio- e para-fisiologiche, si manifestano depressione, deficit delle funzioni cognitive, disturbi del sonno, problemi di socializzazione, con incremento dell’accesso ai servizi sanitari e conseguente innalzarsi dei costi per il Sistema Sanitario.
Tutte queste problematiche sono direttamente associate alla presenza di dolore nell’anziano. È’ necessaria un’ottimizzazione delle strategie di gestione del dolore, con l’obiettivo di ridurre i rischi associati al trattamento farmacologico.
Il paracetamolo e i FANS giocano un ruolo prioritario nel trattamento del dolore. L’evidenza attuale di una potenziale tossicità sia dei FANS non selettivi, sia degli inibitori della COX2, ha indotto ad una rivalutazione del loro utilizzo (5-7). L’impiego dei FANS ha un particolare impatto sugli anziani, i quali sono maggiormente esposti al rischio di eventi avversi legati al loro consumo.
Come suggerito da recenti linee guida, la scelta di analgesici topici, dimostratisi più sicuri ed efficaci negli anziani rispetto a somministrazioni orali, può essere di grande utilità nella gestione di situazioni acute (8).
Per quanto riguarda gli oppioidi, la conoscenza delle specificità farmacocinetiche, del corretto dosaggio analgesico e degli effetti collaterali, è necessaria per un utilizzo sicuro ed efficace. Utilizzare in maniera appropriata i farmaci coadiuvanti analgesici come antiepilettici, antidepressivi e anestetici locali, può essere associato all’impiego degli oppioidi, specialmente nei casi di dolore neuropatico (9).
La promozione, sia per il paziente che per gli addetti all’assistenza sanitaria, di un’opportuna educazione sulle tematiche del dolore, il trattamento dello stesso e i farmaci appropriati, è un passo essenziale per ridurre prescrizioni inadeguate, auto prescrizioni e insorgenza degli effetti collaterali (10).
Negli anziani sono più frequenti molte sindromi e/o patologie disfunzionali, che possono anche portare a dolore acuto severo. Le più frequenti sono la riesacerbazione dell’artrite nelle sue varie forme e distretti, le fratture da osteoporosi, il dolore neoplastico ma anche il dolore derivante da altre affezioni organiche, come cardiopatia ischemica, herpes zoster, vasculopatia periferica, neuropatia diabetica, ulcere da decubito, frattura di anca e/o depressione. Molti fattori possono combinarsi per rendere più difficile un controllo efficace del dolore acuto negli anziani rispetto ai pazienti più giovani. Una maggiore incidenza di diverse patologie coesistenti e terapie polifarmacologiche concorrenti, possono incrementare il rischio di interazioni farmaco-farmaco e patologia-farmaco (11). Essenziale il concetto di fragilità che riassume diversi e specifici sintomi e segni che ben descrivono la vulnerabilità di questi pazienti a fattori di stress così come risulta essere il dolore acuto (12). L’anziano fragile soffre di astenia, affaticamento, più o meno severi deficit cognitivi, perdita di equilibrio, rallentamento motorio e limitazione al movimento fino a vera e prorpia perdita di alcune funzioni. Il trattamento del dolore in questi pazienti fragili è cruciale per aumentare il loro comfort e la soddisfazione nei trattamenti, così da raggiungere buoni risultati complessivi (9). Le differenze legate all’età nell’elaborazione dei processi dolorosi potrebbero fornire potenzialmente una spiegazione dell’aumento della vulnerabilità dell’anziano rispetto al dolore acuto e cronico.
Fisiologia e percezione del dolore negli anziani
La letteratura sui cambiamenti neurotrasmettitoriali, e sulla associata differenza della morfologia cerebrale in età avanzata, ha già un largo riconoscimento per quanto riguarda la diminuzione del volume di specifiche aree del cervello, che determina il ben noto incremento del volume ventricolare. Ciò che è noto come atrofia cerebrale senile e idrocefalo normoteso dell’anziano. Lo studio delle sezioni trasversali e longitudinali descrivono l’ippocampo, la corteccia prefrontale, la corteccia temporale inferiore, il cervelletto e il nucleo striato come le aree cerebrali maggiormente soggette a diminuzione di volume con l’avanzare dell’età (13). Evidenze scientifiche hanno indicato come diversi fattori (decremento neuronale, perdita delle spine dendritiche, riduzione delle sinapsi) sono la vera base isto-patologica della rarefazione della materia grigia nelle circonvoluzioni in età avanzata (14). Probabilmente anche la perdita di sostanza bianca contribuisce al sostanziale decremento del volume cerebrale (15). In relazione alla processazione degli stimoli nocicettivi con un malfunzionamento del sistema di trasmissione del dolore sono state largamente dimostrate numerose alterazioni nella struttura, neurochimica e funzione del sistema nervoso centrale (SNC) e sistema nervoso periferico (SNP), compreso il deterioramento delle vie neurotrasmettitoriali oppiodergiche o dei sistemi serotoninergici e dopaminergici, associati. La corteccia prefrontale e l’ippocampo sono i più importanti componenti del SNC coinvolti nell’atrofia legata all’invecchiamento. Le aree posteriori del cervello (midollo allungato) cruciali per la decodifica e la risposta all’input doloroso (connessioni discendenti modulatorie delle corna posteriori) conservano le stesse dimensioni con l’avanzare dell’età. Anche la neurochimica del cervello è soggetta a cambiamenti legati all’invecchiamento, con una sostanziale diminuzione di dopamina e serotonina (16,17). L’atrofia degli assoni è più difficilmente dimostrabile. Il peggioramento con l’avanzare dell’età della conduzione neuronale e dell’emodinamica endocerebrale e liquorale si accompagna a numerosi fattori che contribuiscono anche alla riduzione dell’attività nervosa periferica (18). I nervi periferici mostrano un decremento nella densità sia delle fibre nervose periferiche mieliniche, sia, in modo particolare di quelle a-mieliniche. Negli anziani un incremento nel numero di fibre con segni di danneggiamento o degenerazione si manifesta con un decremento della velocità di conduzione a livello delle terminazioni nervose. Studi sugli animali mostrano che l’invecchiamento ha effetti significativi sulla morfologia e sui meccanismi bio-funzionali del SNP (19). In osservazioni condotte nei topi da laboratorio, sono state rilevate riduzioni della sostanza P, del peptide gene-correlato della calcitonina (CGRP), mentre i livelli di somatostatina hanno mostrato livelli sovrapponibili ai controlli. Se le fibre si rigenerano, questi assoni hanno meno sinaspsi terminali e collaterali, il risultato è una trasmissione e modulazione anomala degli stimoli nocicettoriali.
Nei topi di laboratorio in età avanzata è anche stato dimostrato che c’è una graduale degenerazione delle vie serotoninergiche che noradrenergiche della lamina superficiale del corno dorsale (20). Questi neuroni controllano la funzione di modulazione delle vie discendenti inibitorie bulbospinali, e tale deficit può interrompere i meccanismi endogeni di controllo del dolore. A livello sovraspinale, si può verificare un deficit di neurotrasmissione (21)per il decremento del turnover metabolico e per la riduzione dei neuroni e delle proiezioni dendritiche che attraversano tutta la corteccia cerebrale, il mesencefalo e le aree posteriori del cervello (22). Di pari passo, quindi, vanno la diminuzione dei neuroni noradrenergici e serotoninergici con l’indebolimento dei meccanismi inibitori discendenti. Probabilmente questo potrebbe spiegare la diminuzione della tolleranza al dolore osservata nelle persone anziane. In relazione all’invecchiamento è stata dimostrata la perdita dei neuroni e delle proiezioni dendritiche nel cervello, sia a livello spinale che periferico come nella corteccia cerebrale, comprendendo anche le aree coinvolte nei processi nocicettoriali. È ovvio che tali differenze neurotrofiche, per lo più molecolari, hanno una differente incidenza reale e macroscopica, sulla qualità della vita dei pazienti e aumentano le soggettive necessità di trattamento per i pazienti più anziani, quanto più spiccate esse si presentino. I cambiamenti nei pattern recettoriali periferici sono indicati come elementi responsabili dell’aumento della soglia del dolore con l’invecchiamento, con evidenze sperimentali che documentano l’aumentato contributo delle fibre C nocicettive, in aggiunta alla perdita di fibre A (23). Esistono importanti esperienze cliniche sulla soglia e la tolleranza al dolore.
Gibson, nel 2003, ha condotto una metanalisi che ha esaminato più di 50 studi nei quali sono stati osservate differenze di sensibilità al dolore indotto in relazione a diverse fasce d’età. I risultati finali hanno indicato che c’è una netta evidenza dell’aumento della soglia del dolore con l’avanzare dell’età anche in relazione al tipo di dolore indotto (24). Un altro studio ha inteso stimare la diminuzione della tolleranza al dolore; Lasch et al hanno infatti esaminato la risposta al dolore causato da dilatazione viscerale da pallone intraesofageo in campioni di giovani in buona salute e negli anziani (25). È stato misurato il volume di aria presente nel pallone nel momento in cui il soggetto riferiva dolore.
Il volume di aria percepito come doloroso per il paziente era significativamente maggiore negli anziani. Le persone anziane sembrerebbero estremamente tolleranti rispetto ai pazienti più giovani, e la maggior parte di essi non riferisce dolore persino dopo aver gonfiato il pallone al massimo livello (26). Un altro cambiamento fisiologico influenza il dolore negli anziani, ovvero la ridotta densità dei recettori oppioidi. Questi recettori cerebrali risultano depauperati a livello centrale, ma non quelli del midollo spinale, ci potrebbe essere anche una diminuzione degli oppioidi endogeni. Sono state osservate le conseguenze funzionali di tali dati anatomici, mediante lo studio con la più recente diagnostica per immagini quale la risonanza magnetica funzionale (MRI/fMRI) che dimostra una sostanziale sovrapposizione delle aree che attivano la risposta nel cervello a stimolazioni dolorose acute (27). Queste osservazioni sperimentali potrebbero essere trasformate in elementi clinici, dove il dolore è il risultato di un danno tissutale, suggerendo come qualche deficit nella funzione di risposta precoce ad uno stimolo nocivo potrebbe causare un danno tissutale peggiore (27). Per esempio, nei pazienti con coronaropatia acuta, la severità del dolore precordiale è in contrasto con una soglia del dolore più bassa(28); pazienti coronarici con dolore avvertito come lieve potrebbero ricevere trattamento in ritardo.
Valutazione del dolore acuto negli anziani
Studi condotti su persone anziane dimostrano che una corretta valutazione del dolore migliora la qualità della cura, sia in termini di somministrazione degli analgesici che di strategie terapeutiche, permettendo maggiori successi nelle condizioni di dolore acuto (29,30). Oltre alla valutazione è necessaria anche una frequente ri-valutazione nel tempo del dolore per stabilire un corretto dosaggio finale e titraggio degli analgesici oppioidi negli anziani.
Potenziali ostacoli per una corretta valutazione del trattamento del dolore includono anche aspetti psicologici dei pazienti anziani, quali:
- ansia;
- depressione:
- disturbi cognitivi;
- problemi alla vista e all’udito;
- isolamento sociale o famigliare;
così come la principale barriera culturale rappresentata dalla errata convinzione che il dolore possa essere una normale componente dell’invecchiamento.
Il trattamento del dolore negli anziani inoltre si scontra con problemi farmacodinamici e farmacocinetici da tenere attentamente in considerazione (31,32). Sono stati descritti e somministrati a pazienti anziani numerosi test o scale, essenziali strumenti di valutazione del dolore (33). Pazienti sani dal punto di vista cognitivo sono valutati attraverso la Verbal NRS (Verbal Numeric Rating Scale) e dalla VDS (Verbal Description Scale) (34).
Queste sono le scale di valutazione del dolore acuto più facili da impiegare e più comunemente usate, ben applicabili e accettate dai pazienti (35). La VAS (Visual Analog Pain Scale) presenta con l’aumentare dell’età del paziente una più alta frequenza di risposte incomplete o scarsamente valutabili (36). La VDS sembra essere uno strumento più sensibile e specifico per la misurazione del dolore negli anziani rispetto alla NRS, ma risulta essere maggiormente efficace solo in minima parte in assenza di deficit mentale (37).
Gestione del dolore in pazienti anziani con demenza e deficit cognitivo
La valutazione e il trattamento del dolore in persone anziane affette da deficit cognitivo rappresenta attualmente una delle sfide più complesse. Per deficit cognitivo si intende il difetto o più difetti nel processo attraverso il quale la persona percepisce, codifica, immagazzina, recupera e usa un’informazione.
Molteplici condizioni possono portare deficit cognitivo:
demenze: malattia di Alzheimer, AD, demenza vascolare, VD, demenza frontotemporale, FTD, malattia di Parkinson con demenza, PDD, malattia dei Corpi di Lewi
morbo di Creutzfeldt-jakob
delirio
accidenti cerebrovascolari
stato di incoscienza, ICU, intubazione
depressione severa
psicosi
disabilità mentale
coma, stato vegetativo persistente
encefalopatie
malattie terminali.
L’invecchiamento rappresenta il maggior fattore di rischio per l’insorgenza sia di demenza che di dolore, che della loro coesistenza. Il graduale e progressivo invecchiamento della popolazione nel mondo occidentale condurrà, nei prossimi decenni, ad un aumento del numero di anziani che soffrono di demenza associata a condizioni dolorose. Demenza e dolore sono fenomeni complessi, considerando i diversi sottotipi di demenza, e i diversi modi in cui il dolore si esprime (dolore nocicettivo, neuropatico, centrale). Gli aspetti clinici della demenza, inclusi i deficit di memoria, i disturbi nella funzione esecutiva, l’afasia, l’aprassia e l’agnosia, interferiscono progressivamente su tutti gli aspetti delle funzioni cognitivo-comportamentali degli individui. L’inabilità ad usare il linguaggio verbale rappresenta l’ostacolo maggiore, oltre che un fattore di possibile fraintendimento, per l’identificazione e il trattamento del dolore in questi pazienti. Con l’instaurarsi del deficit del linguaggio, l’abilità di comunicare verbalmente attraverso segni non-verbali o con la scrittura, nonché la facoltà di comprendere tali codici, può venir compromessa severamente. La progressiva perdita di abilità introspettive e di comprensione degli stati interiori è, se possibile, ancora più importante, essendo questi processi essenziali per identificare le sensazioni e le emozioni legate alla percezione del dolore.
Ci sono due ulteriori barriere culturali difficili da superare: primo, la convinzione che nulla può essere fatto per i pazienti con demenza; secondo, le persone affette da demenza non percepiscono il dolore, quindi non necessitano di farmaci o di altri interventi specifici per il trattamento del dolore (38) entrambe le affermazioni sono confutate dalle evidenze scientifiche. I pazienti con deficit cognitivo soffrono di malattie e condizioni dolorose esattamente quanto i pazienti cognitivamente sani della stessa età; ma il numero di casi riportati e trattati per le varie condizioni dolorose decresce con l’aumentare di deficit cognitivo (39,40). Comunque, studi su pazienti con demenza fanno ritenere mendace l’affermazione che essi sperimentino meno la sensazione dolorosa rispetto agli altri (41,42). I processi relativi agli aspetti sensoriali avvengono nel sistema talamico e spinale laterale del dolore, mentre gli aspetti emotivi, affettivi, cognitivi, la memoria del dolore e le risposte neuro-endocrine vengono processate dal sistema mediale sopra e sotto-spinale (43). La distinzione fra questi aspetti del dolore e i due sistemi neurotrasmettitoriali del dolore ha mostrato la sua importanza in molteplici studi clinici e sperimentali sul dolore in diversi sottotipi di demenza.
Altri studi hanno evidenziato che a livello somato-sensoriale le risposte agli stimoli dolorosi in pazienti con deficit cognitivo e pazienti cognitivamente sani, sono equivalenti; ovvero lo stimolo doloroso viene adeguatamente percepito (sistema laterale del dolore) (44,45). Tuttavia, è stato osservato che i processi di trasmissione del dolore che coinvolgono aree del sistema mediale (come il giro cingolato anteriore) in pazienti con demenza severa, risultano compromessi (46). Benedetti et al. hanno osservato che la soglia del dolore (aspetto sensoriale discriminativo) dei pazienti con Alzheimer non differisce da quella di anziani senza demenza, laddove invece, la tolleranza al dolore (aspetto emotivo/affettivo) aumenta significativamente nel gruppo di pazienti con Alzheimer (47).
Queste scoperte hanno mostrato chiaramente che le aree che appartengono al sistema mediale del dolore (come i nuclei intralaminari talamici) giocano un ruolo importante nel processo emotivo-motivazionale-affettivo del dolore e sono severamente colpiti nella malattia di Alzheimer (48). Al contrario, le aree sensoriali primarie (il sistema laterale del dolore) rimangono relativamente preservate nella malattia di Alzheimer, il che spiega la soglia nocicettoriale immutata (49).I pazienti con malattia di Alzheimer, nonostante percepiscano la presenza del dolore, possono sperimentarne l’intensità e gli aspetti emotivi con intensità differente. Di conseguenza, le persone con demenza possono comprendere scarsamente il significato della sensazione e il suo giusto posizionamento nel contesto emozionale. Questo potrebbe potenzialmente spiegare le risposte comportamentali atipiche osservate in questa popolazione di pazienti (ad esempio espressioni accigliate o spaventate, combattività, ritrosia, agitazione) (50,51). Nella malattia di Alzheimer e nella demenza frontoparietale il cambiamento nel processo delle componenti emotive del dolore sperimentale (maggiore tolleranza) sembra ricalcare il decremento rilevato anche nel dolore come esperienza clinica (52.53).
Un’analisi completa della neuropatologia di questi disordini indica che l’atrofia della corteccia prefrontale nella demenza frontotemporale, e le lesioni della sostanza bianca nella demenza vascolare, potrebbero essere responsabili dei rispettivi incrementi e decrementi clinicamente osservati negli aspetti emotivo-affettivi del dolore (48). Benedetti et al. hanno inoltre valutato la risposta placebo delle terapie analgesiche osservando gli effetti dell’anestetico locale post-venipuntura somministrato apertamente oppure di nascosto a pazienti con Alzheimer; i pazienti con punteggi ridotti di Frontal Assessment Battery (FAB, uno strumento di misurazione della funzione esecutiva frontale) mostravano una componente placebo ridotta e richiedevano un incremento del dosaggio per una analgesia adeguata (54).
Un’altra forma molto comune di deficit cognitivo acuto nei pazienti anziani è rappresentato dal delirio e dalla confusione. Questa condizione è associata con l’incremento della morbilità postoperatoria, riabilitazione postoperatoria inefficace e ospedalizzazione prolungata (55). Il delirio è più comune durante le malattie acute nelle persone anziane e compare fino all’80% dei pazienti nel periodo postoperatorio, a seconda del tipo di intervento. In un’analisi sistematica, Newman et al. hanno confermato che la disfunzione cognitiva postoperatoria (POCD) è relativamente comune nella chirurgia non-cardiaca e che i pazienti più anziani sono particolarmente a rischio (56).
Fattori di rischio associati con lo sviluppo del delirio sono:
- età avanzata
- infezione
- demenza progressiva
- depressione pregressa
- ipossiemia e ridotta saturazione di O2 cerebrale
- disintossicazione da sostanze (es. alcol, benzodiazepine)
- squilibrio idro-elettrolitico
- dolore sotto-trattato
- farmaci ad attività anticolinergica centrale: atropina, antidepressivi triciclici, tranquillanti maggiori, alcuni antiemetici
- benzodiazepine
- oppiacei
- ketamina
- ipoglicemizzanti orali
- FANS
- anticonvulsivanti.
Valutazione del dolore negli anziani con deficit cognitivo
Spesso i medici credono che le persone anziane con deficit cognitivo avvertano e vivano il dolore in misura minore, ma i risultati emersi da indagini cliniche suggeriscono che questo potrebbe non essere lo scenario reale. Il modo in cui la sensazione dolorosa viene interpretata dall’anziano e/o dal paziente demente può avere un impatto sulle espressioni del dolore (p. es. vocalizzazioni, espressioni facciali, movimenti e posture, attività e comportamenti) e su come vengono interpretate dall’osservatore (38). Proprio in questo risiede la sfida di una corretta valutazione. Procedure raccomandate per l’identificazione del dolore in questa popolazione sono state proposte dagli esperti e basate sull’assunto che le condizioni dolorose affliggono allo stesso modo quelli che possono e quelli che non possono riferirle (57,58). La comunicazione dei sintomi da parte del paziente viene considerata la chiave per determinare e quantificare la severità del dolore e molte persone con demenza posseggono questa abilità; tentare di ottenere ciò direttamente dal paziente anziano è un primo passo raccomandato.
Strumenti di valutazione del dolore semplici, validi e affidabili, includono scale descrittive verbali, scale analogiche del dolore (verbali e numeriche) e scale della mimica facciale (58). Nel caso in cui la comunicazione da parte del paziente non sia ritenuta attendibile, bisognerà usare metodi diversi, inclusa l’osservazione di comportamenti chiave (p.es., mimica facciale, sguardo), che può essere effettuata dal sanitario, o anche mediata dai resoconti di assistenti e familiari. Generalmente, le scale di autovalutazione del dolore possono essere usate con affidabilità nella maggior parte degli anziani con deficit cognitivo da lieve a moderato, e in un numero significativo di anziani con deficit severo.
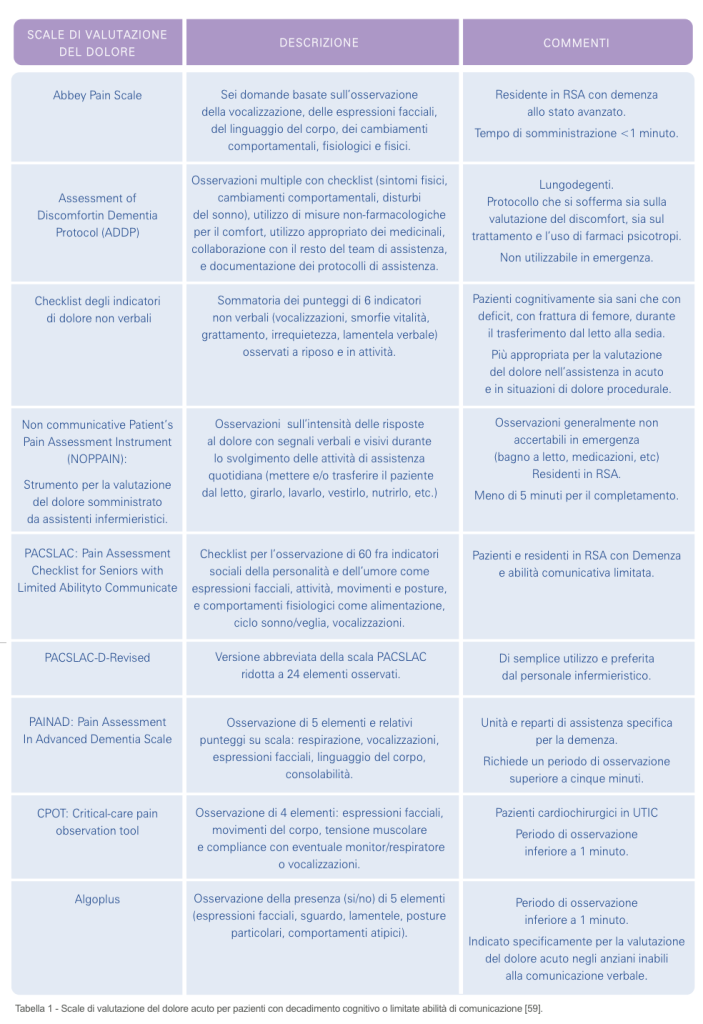
Comportamenti come irrequietezza, minacciosità, smorfie, oppure borbottare o emettere altri suoni e vocalizzazioni atipiche, sono stati usati in diversi tentativi di valutazione della severità del dolore; comunque essi potrebbero non essere sempre dei validi indicatori di dolore nell’adulto “non-verbalizzante” (40), essendo di difficile interpretazione (41). Suoni emessi e mimica facciale possono essere indicatori accurati della presenza di dolore, ma non della sua intensità nei pazienti con demenza avanzata (41). Nel corso degli ultimi quindici anni, sono stati sviluppati diversi strumenti, basati sull’osservazione dei comportamenti, per la valutazione del dolore negli adulti “non-verbalizzanti” con diversi gradi di demenza; quelli disponibili e testati nella valutazione del dolore acuto sono descritti nella Tabella 1 (59,60).
Conclusioni
È difficile raggiungere una conoscenza profonda dell’interazione dinamica fra i cambiamenti cerebrali di natura strutturale e funzionale legati all’invecchiamento. Così come è altrettanto difficile creare uno schema o un algoritmo semplice per il trattamento del dolore nei pazienti geriatrici. Se è vero che l’impatto dei cambiamenti strutturali del cervello, legati all’invecchiamento, modificano le risposte organiche allo stimolo doloroso, risulta allora necessario adottare un approccio multimodale che integri le valutazioni sul comportamento, sullo stato cognitivo e sulla funzione cerebrale globale dell’individuo. Sarebbe, in effetti, raccomandabile non costruire un’ipotesi diagnostica o un piano assistenziale basandosi solo sull’età del paziente.
Tutti i pazienti hanno bisogno di un approccio individuale e percorsi diagnostici specifici per arrivare a pianificare l’assistenza basandosi su requisiti individuali, tenendo conto della loro salute fisica e mentale, delle loro aspettative, delle circostanze sociali in cui vivono (ambiente domestico, comunità, isolamento) nonché ambientali (livello socio-economico e culturale) e del loro benessere globale (presenza di co-morbidità, dal diabete al cancro). Ciò a maggior ragione diviene essenziale di fronte alle fragilità combinate dell’età avanzata e della demenza. In questa difficile combinazione di condizioni cliniche e psico-disfunzionali diviene fondante un approccio valutativo, farmacologico e non-farmacologico individualizzato e specifico, al fine di rilevare e trattare efficacemente il dolore. Quest’ultimo, infatti, è già di per se elemento scatenante di importanti stati disforici e di alterazione cognitiva, diventando pericoloso innesco di stress e scarsa risposta terapeutica, già solo in presenza di età avanzata. Il processo di cura deve comprendere, per tali motivi, il trattamento del dolore acuto nel paziente anziano e in particolare con demenza, al fine di evitare complicanze e ricadute di tipo psichico e fisico che interagiscano con l’estrema fragilità dei soggetti che le presentano.
Bibliografia
1. Platts-Mills TF, Esserman DA, Brown DL, et al. Older US emergency department patients are less likely to receive pain medication than younger patients: results from a national survey. Annals Emerg Med 2012;60(2):199–206.
2. Coker E, Papaioannou A, Turpie I, et al. Pain management practices with older adults on acute medical units. Perspectives 2008;32:5–12.
3. Gibson SJ, Lussier D. Prevalence and relevance of pain in older persons. Pain Med. 2012;13 Suppl 2:S23-6.
4. Taylor R Jr, Lemtouni S, Weiss K, Pergolizzi JV Jr. Pain Management in the Elderly: An FDA Safe Use Initiative Expert Panel’s View on Preventable Harm Associated with NSAID Therapy. Curr Gerontol Geriatr Res. 2012;2012:196159. doi: 10.1155/2012/196159.
5. Barkin RL, Beckerman M, Blum SL, Clark FM, Koh EK, Wu DS: Should nonsteroidal anti-inflammatory drugs (NSAIDs) be prescribed to the older adult? Drugs Aging. 2010;27(10):775-89.
6. Barkin RL, Buvanendran A: Focus on the COX-1 and COX-2 agents: renal events of nonsteroidal and antiinflammatory drugs—NSAIDs. Am J Ther. 2004;11:124–129.
7. Andersohn F, Suissa S, Garbe E: Use of first- and second generation cyclooxygenase-2-selective nonsteroidal antiinflammatory drugs and risk of acute myocardial infarction. Circulation. 2006; 113:1950–1957.
8. McClean G. Topical analgesic agent. Clin Geriatr Med. 2008; 24:299-312.
9. McLachlan AJ, Bath S, Naganathan V, Hilmer SN, Le Couteur DG, Gibson SJ, Blyth FM. Clinical pharmacology of analgesic medicines in older people: impact of frailty and cognitive impairment. Br J Clin Pharmacol. 2011 M;71(3):351-64.
10. Mehta SS, Siegler EL, Henderson CR Jr, Reid MC. Acute pain management in hospitalized patients with cognitive impairment: a study of provider practices and treatment outcomes. Pain Med. 2010;11(10):1516-24.
11. Taylor R Jr, Lemtouni S, Weiss K, Pergolizzi JV Jr Pain Management in the Elderly: An FDA Safe Use Initiative Expert Panel’s View on Preventable Harm Associated with NSAID Therapy. Curr Gerontol Geriatr Res. 2012;2012:196159.
12. Walston J, Hadley EC, Ferrucci L et al. Research agenda for frailty in older adults: toward a better understanding of physiology and etiology: summary from the American geriatrics society/national institute on aging research conference on frailty in older adults. Journal of the American Geriatrics Society 2006;54:991-1001
13. Walhovd KB, Westlye LT, Amlien I, et al. Consistent neuroanatomical age-related volume differences across multiple samples. Neurobiol Aging 2011;32(5): 916–32.
14. Dickstein DL, Kabaso D, Rocher AB, et al. Changes in the structural complexity of the aged brain. Aging Cell 2007;6(3):275–84.
15. Sala S, Agosta F, Pagani E, Coppetti M, Comi G, Filippi M. Microstructural changes and atrophy in brain white matter tracts with aging. Neurobiol Aging. 2012;33(3):488-498.
16. Kaasinen V, Vilkman H, Hietala J, et al. Age-related dopamine D2/D3 receptor loss in extrastriatal regions of the human brain. Neurobiol Aging 2000;21(5):683–8.
17. Adams KH, Pinborg LH, Svarer C, et al. A database of [(18)F]-altanserin binding to 5-HT(2A) receptors in normal volunteers: Normative data and relationship to physiological and demographic variables. Neuroimage 2004;21(3):1105–13.
18. Verdu E, Ceballos D, Vilches JJ, et al. Influence of age on peripheral nerve function and regeneration. J Peripher Nerve Syst 200;5:191–208.
19. Khalil Z, Ralevic V, Bassirit M, et al. 1994. Effects of ageing on sensory nerve function in rat skin. Brain Res 1994;641:265–72.
20. Laporte AM, Doyen C, Nevo IT.. Autoradiographic mapping of serotonin 5HT1A, 5HT1D, 5HT2A and 5HT3 receptors in the aged human spinal cord. J Chem Neuroanat. 1996;11:67–75.
21. Barili P, De Carolis G, Zaccheo D, et al. 1998. Sensitivity to ageing of the limbic dopaminergic system: a review. Mech Ageing Dev, 106:57–92.
22. Pakkenberg B, Gundersen HJ. Neocortical neuron numbers in humans: effects of sex and age. J Comp Neurol 1997;384:312–20.
23. Chakour MC, Gibson SJ, Bradbeer M, Helme RD. The effect of age on A delta- and C-fibre thermal pain perception. Pain 1996;64(1):143–52.
24. Gibson SJ.. Pain and aging: the pain experience over the adult lifespan. In Proceedings of the 10th World Congress on Pain, IASP Press, Seattle, 2003.
25. Lasch H, Castell DO, Castell JA. Evidence for diminished visceral pain with aging; studies using graded intraesophageal balloon distension. Am J Physio 1997;272:G1–3.
26. Cole LJ, Farrell MJ, Gibson SJ, Gibson SJ, Egan GF. Age-related differences in pain sensitivity and regional brain activity evoked by noxious pressure. Neurobiol Aging. 2010; 31(3): 494-503.
27. Gibson SJ. Older people’s pain. Pain: Clinical Updates. 2006 (IASP) 14(3).
28. Granot M, Khoury R, Berger G et al. Clinical and experimental pain perception is attenuated in patients with painless myocardial infarction. Pain. 2007;133(1-3): 120–7.
29. Iyer RG. Pain documentation and predictors of analgesic prescribing for elderly patients during emergency department visits. J Pain Symptom Manage. 2010;41: 367–73.
30. Silka PA, Roth MM, Moreno G, et al. Pain scores improve analgesic administration patterns for trauma patients in the emergency department. Acad Emerg Med. 2004;11:264–70.
31. Duignan M, Dunn V. Barriers to pain management in emergency departments. Emerg Nurse 2008;15(9):30–4.
32. Rupp T, Delaney K. Inadequate analgesia in emergency medicine. Ann Emerg Med 2004;43:494–503.
33. Gagliese L, Katz J, Melzack R. Pain in the elderly. In Wall PD & Melzack R (eds.). Textbook of pain. 4th ed. London: Churchill Livingstone, 1999, pp. 991, 1006.
34. Jensen MP, Karoly P & Braver S. The measurement of clinical pain intensity: a comparison of six methods. Pain 1986; 27: 117, 126.
35. Ware LJ, Epps CD, Herr K, et al. Evaluation of the revised faces pain scale, verbal descriptor scale, numeric rating scale, and Iowa pain thermometer in older minority adults. Pain Manag Nurs 2006;7(3):117–25.
36. Gagliese L, Katz J. Age differences in postoperative pain are scale dependent: a comparison of measures of pain intensity and quality in younger and older surgical patients. Pain 2003; 103: 11-20.
37. Herr K, Spratt K, Mobiliy P, et al. Pain intensity assessment in older adults: use of experimental pain to compare psychometric properties and usability of selected pain scales with younger adults. Clin J Pain 2004;20:207-19.
38. Bjoro K, Herr K. Assessment of pain in the nonverbal or cognitively impaired older adult. Clin Geriatr Med. 2008;24(2):237-62.
39. Smith M. Pain assessment in nonverbal older adults with advanced dementia. Perspect Psychiatr Care. 2005;41(3):99-113.
40. Farrell MJ, Katz B, Helme RD. The impact of dementia on the pain experience. Pain. 1996;67(1): 7–15.
41. Herr K, Bjoro K, Decker S. Tools for assessment of pain in nonverbal older adults with dementia: a state-of-the-science review. J Pain Symptom Manage 2006;31(2):170–92.
42. Rainero I, Vighetti S, Bergamasco B, Pinessi L, Benedetti F. Autonomic responses and pain perception in Alzheimer’s disease. Eur J Pain 2000;4:267-74.
43. Benedetti F, Arduino C, Vighetti S, Asteggiano G, Tarenzi L, Rainero I. Pain reactivity in Alzheimer patients with different degrees of cognitive impairment and brain electrical activity deterioration. Pain 2004;111:22-9.
44. Sewards TV, Sewards MA. The medial pain system: neural representations of the motivational aspect of pain. Brain Res Bull 2002;59:163-80.
45. Cole LJ, Farrell MJ, Duff EP et al. Pain sensitivity and fMRI pain-related brain activity in Alzheimer’s disease. Brain 2006;129:2957–65.
46. Yamamoto M, Kachi T, Igata A. Pain-related somatosensory evoked potentials in dementia. J Neurol Sci 1996;137:117-9.
47. Benedetti F, Vighetti S, Ricco C, Lagna E, Bergamasco B, Pinessi L, et al. Pain threshold and pain tolerance in Alzheimer’s disease. Pain 1999;80:377-82.
48. Rüb U, Del Tredici K, Del Turco D, Braak H. The intralaminar nuclei assigned to the medial pain system and other components of this system are early and progressively affected by Alzheimer’s disease-related cytoskeletal pathology. J Chem Neuroanat 2002;23:279-90.
49. Scherder EJA, Sergeant JA, Swaab DF. Pain processing in dementia and its relation to neuropathology. Lancet Neurol 2003;2:677-86.
50. Scherder E, Herr K, Pickering G, Gibson S, Benedetti F, Lautenbacher S. Pain in dementia Pain. 2009;145(3):276-8.
51. Scherder E, Oosterman J, Swaab D, et al. Recent developments in pain in dementia. BMJ. 2005;26;330(7489):461-4..
52. Scherder EJA, Bouma A. Visual analogue scales for pain assessment in Alzheimer’s disease. Gerontology 2000;46:47-53.
53. Carlino E, Benedetti F, Rainero I, et al. Pain perception and tolerance in patients with frontotemporal dementia. Pain. 2010;151(3):783-9.
54. Benedetti F, Arduino C, Costa S, Vighetti S, Tarenzi L, Rainero I, Asteggiano G. Loss of expectation-related mechanisms in Alzheimer’s disease makes analgesic therapies less effective. Pain 2006;121:133-44.
55. Greene NH, Attix DK, Weldon BC et al . Measures of executive function and depression identify patients at risk for postoperative delirium. Anesthesiology. 2009;110(4):788-95.
56. Newman S, Stygall J, Hirani S et al. Postoperative cognitive dysfunction after noncardiac surgery: a systematic review. Anesthesiology 2007; 106(3): 572-90.
57. Hadjistavropoulos T, Herr K, Turk DC, et al. An interdisciplinary expert consensus statement on assessment of pain in older persons. Clin J Pain 2007;23(Suppl.1):S1-S43.
58. Pergolizzi J, Böger RH, Budd K, et al. Opioids and the management of chronic severe pain in the elderly: consensus statement of an International Expert Panel with focus on the six clinically most often used World Health Organization step III opioids (buprenorphine, fentanyl, hydromorphone methadone, morphine, oxycodone. Pain Pract 2008;8:287-313.
59. Herr K, Spratt KF, Garand L, Li L. Evaluation of the Iowa pain thermometer and other selected pain intensity scales in younger and older adult cohorts using controlled clinical pain: a preliminary study. Pain Med 2007;8:587-600.
60. Hwang U, Platts-Mills TF. Acute pain management in older adults in the emergency department. Clin Geriatr Med. 2013;29:151-164.