Il dolore in terapia intensiva neonatale: revisione narrativa della letteratura
Introduzione
Il dolore è un sintomo frequente in corso di malattia: spesso segnale importante per la diagnosi iniziale, fattore sensibile nell’indicarne evoluzioni positive o negative, la cui presenza è innegabile in corso di molteplici procedure diagnostiche e/o terapeutiche e costante riflesso di paura e ansia per tutto quello che la malattia comporta (1). Fra tutti, è il sintomo che più mina l’integrità fisica e psichica della persona malata e più angoscia e preoccupa i suoi familiari, con un notevole impatto sulla qualità della vita durante e dopo la malattia. E, se questo è vero per l’adulto, ancora più evidente è per il bambino (1, 2).
È ormai certo, infatti, che non esistono limiti d’età alla percezione del dolore: a partire dalla fine del secondo trimestre di gestazione, il feto possiede la struttura anatomica e neurochimica adeguata per percepire il dolore, e sin dall’età neonatale esiste una “memoria del dolore” (3, 4). Confermate inoltre, da più lavori in letteratura, sono le conseguenze a breve (peggioramento clinico, complicanze, prolungamento dell’ospedalizzazione, ecc.) e a lungo termine (dolore cronico, alterazione della soglia del dolore, problemi psico-relazionali, ecc.) provocate da stimolazioni nocicettive ripetute in età neonatale-pediatrica, non coperte in maniera adeguata con terapia antalgica (5-7). Queste sono alcune delle ragioni per cui è necessario valutare il dolore per trattarloin modo adeguato in tutti i neonati e in tutte le situazioni in cui tale sintomo può manifestarsi (7).
Fino a qualche anno fa, si riteneva che il sistema nervoso del neonato, anche pretermine, e del bambino non fosse in grado di tradurre, trasmettere, modulare e percepire la sensazione dolorosa. A partire dagli anni ’80 un’ampia letteratura ha dimostrato che dalla 23a settimana di età gestazionale il sistema nervoso centrale è anatomicamente e funzionalmente competente per la nocicezione (8). La formazione e la mielinizzazione delle aree nocicettive centrali (talamo, corteccia sensitiva, sistema limbico, ipotalamo e le aree associative corticali cerebrali) si realizzano nel periodo post-natale fino al raggiungimento del primo anno di vita. Nel feto, nel neonato e fino a 12-18 mesi di età, vi è una ritardata espressione delle vie inibitorie discendenti con conseguente ridotta azione antalgica, che determina una maggiore eccitabilità del sistema nocicettivo. A parità di stimolo doloroso, quindi, tanto più giovane è il paziente, minore è l’inibizione centrale e periferica, tanto maggiore è la percezione del dolore (3, 4). La maturazione del sistema algico-antalgico prosegue durante il periodo neonatale e nell’infanzia con lo sviluppo e il perfezionamento di recettori periferici, connessioni intramidollari e intracorticali con il sistema limbico e con le aree associative presenti nella corteccia frontale, parietale e nell’insula (2). L’importanza di questa fase di sviluppo nella maturazione del sistema dolorifico dipende dalla elevata “plasticità” del sistema nervoso centrale e periferico in questo periodo. Da ciò consegue, però, che le stimolazioni dolorose ripetitive consolidano e rinforzano le connessioni in via di sviluppo e possono indurre modificazioni del sistema nervoso immaturo a livello periferico con aumentata proliferazione delle terminazioni nervose periferiche e delle loro connessioni con il corno dorsale del midollo spinale corrispondenti all’area del tessuto danneggiato, a livello spinale, dove le aree del corno dorsale del midollo spinale somatotopicamente correlate con la stimolazione dolorosa ripetuta presentano un’aumentata eccitabilità a riposo e dopo stimolazione (fenomeno del parossismo neuronale) e a livello centrale dove i circuiti neuronali che sono mantenuti attivi proliferano, mentre quelli inattivi degenerano (1, 2). La ripetitività della stimolazione dolorosa ha un impatto importante sulla sopravvivenza neuronale, soprattutto dei neuroni immaturi (2). In questi ultimi anni le conoscenze raggiunte sono tali da poter assicurare un corretto ed efficace approccio antalgico nella quasi totalità dei casi. Se vogliamo trattare il dolore in modo efficace è necessario misurarlo, cioè renderlo quantificabile utilizzando strumenti adeguati, efficaci e validati in letteratura (9).
Per valutare il dolore nel neonato sono state individuate alcune variabili dipendenti che si modificano in modo univoco costante ed anche proporzionale allo stimolo doloroso (2) e sono state elaborate delle scale che prendono in considerazione le modificazioni fisiologiche e comportamentali indotte dal dolore (scale algometriche neonatali) (10-14). Nonostante le sempre maggiori evidenze che il dolore acuto e ripetitivo nel neonato, e in particolare nel pretermine, è causa di alterazioni fisiologiche, comportamentali, ormonali ed endocrine, con potenziali effetti deleteri a breve e lungo termine, ancora frequentemente i neonati ricoverati nelle Terapie Intensive Neonatali (TIN) sono esposti precocemente a stimoli dolorosi non controllati per procedure diagnostiche, terapeutiche e chirurgiche ed è importante implementare interventi migliorativi per valutare e gestire al meglio il dolore (15).
Obiettivo di questo studio sarà effettuare una revisione della letteratura con lo scopo di identificare e definire gli strumenti validati utili per l’accertamento del dolore nelle TIN. Verrà infine fatto il punto su quali scale siano state sottoposte a validazione in lingua italiana e quindi diffuse nel contesto nazionale.
Materiali e metodi
Per reperire le informazioni è stata interrogata la banca dati MEDLINE, ed è stata effettuata una revisione della letteratura. È stata interrogata inoltre la banca dati CINHAL e Cochrane alla ricerca di eventuali revisioni sull’argomento.
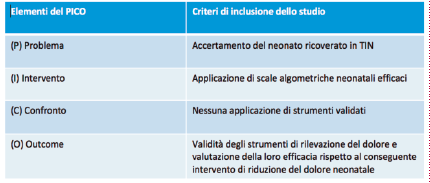
Definito il nostro Pico (Tabella 1), sono stati inclusi tutti gli articoli riguardanti la valutazione del dolore nelle TIN e tutti gli articoli in lingua inglese. Sono stati esclusi tutti gli articoli che non discutono della valutazione del dolore nel neonato e tutti gli articoli che non sono in lingua inglese. Le keyword utilizzate per effettuare la ricerca sono state: scale of assessment of pain and NICU, and validate scale. Con queste parole chiave abbiamo identificato su Medline la seguente stringa di ricerca: ((“Assessment”[Journal] OR “assessment”[All Fields]) AND (“critical care”[MeSH Terms] OR (“critical”[All Fields] AND “care”[All Fields]) OR “critical care”[All Fields] OR (“intensive”[All Fields] AND “care”[All Fields]) OR “intensive care”[All Fields])) AND ((“pain”[MeSH Terms] OR “pain”[All Fields]) AND neonatal[All Fields]).
Non abbiamo posto limite di anni, al fine di includere il maggior numero di pubblicazioni sull’argomento. Per censire e valutare gli strumenti di accertamento è stata analizzata criticamente una revisione integrativa del 2014 (11) e sono state quindi realizzate ricerche ascendenti e discendenti mediante Scopus database. Successivamente, per ogni strumento individuato si è proceduto con una ricerca manuale, allo scopo di trovare gli studi di validazione di ogni singolo strumento. Per ampliare la nostra ricerca ed evidenziare gli studi di validazione in lingua italiana, è stato inoltre visitato il sito della Società Italiana di Neonatologia (www.neonatologia.it), le linee guida del Ministero della Salute e la banca dati bibliografica ILISI (Indice della Letteratura Italiana delle Scienze Infermieristiche).
Risultati
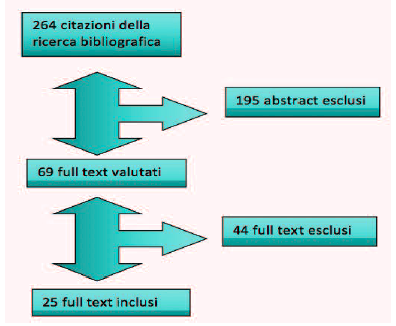
Sono state reperite inizialmente 264 citazioni bibliografiche. Di queste, abbiamo valutato 69 full-text, identificato 30 scale validate per la valutazione del dolore nel neonato. Tuttavia, dopo un’analisi riguardante i singoli studi di validazione delle stesse abbiamo convenuto di escluderne 5 in quanto non particolarmente specifiche per la TIN o per il neonato, oppure perché non erano ben definiti i criteri di età e tipo di dolore valutato, raggiungendo un totale di 25 scale di valutazione (Figura 1). Di queste, 13 sono scale unidimensionali e 12 sono scale multidimensionali.
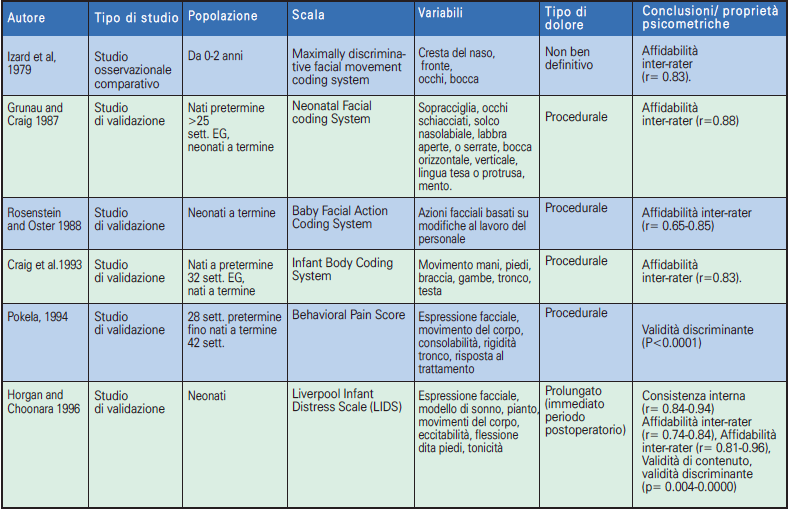
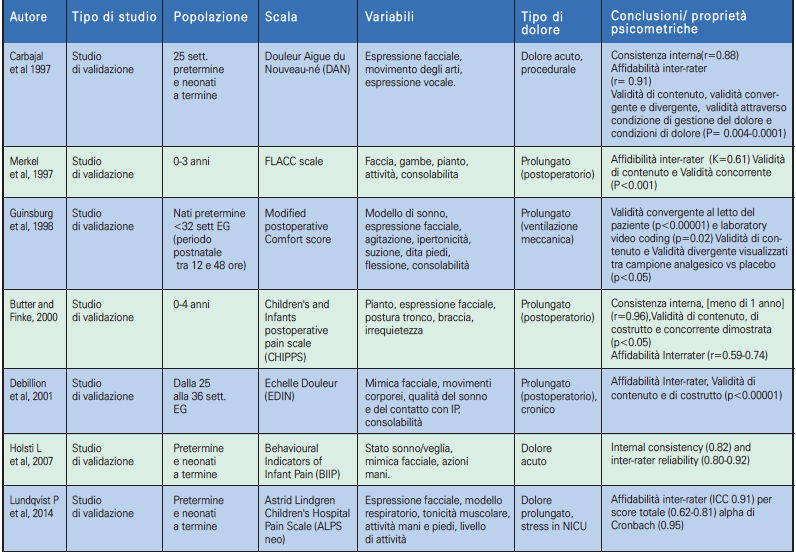
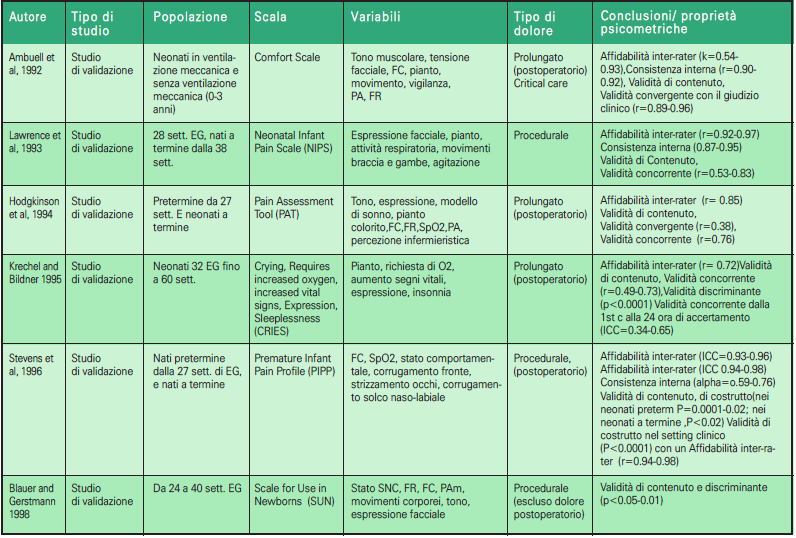
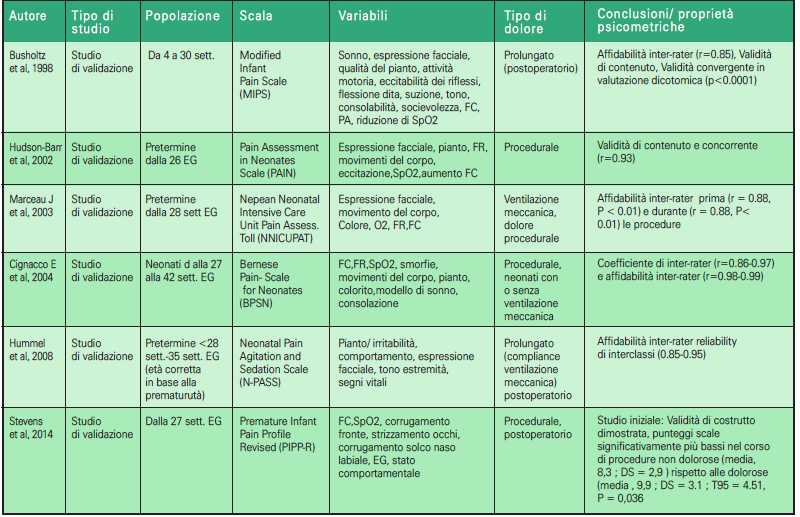
Gli strumenti unidimensionali utilizzano un unico indicatore di valutazione del dolore: psicologico o comportamentale; mentre gli strumenti multidimensionali sono quelli che forniscono una valutazione più completa del dolore, in quanto comprendono sia gli aspetti fisiologici che comportamentali. Gli indicatori più comunemente usati sono i segni vitali, come la frequenza cardiaca e la saturazione di ossigeno, e le misure comportamentali come l’espressione del volto, il pianto e l’attività motoria. Le scale di valutazione del dolore valide per le TIN sono state riassunte nelle tabelle e suddivise in scale unidimensionali (Tabella 2.1, 2.2) e multidimensionali (Tabella 3.1, 3.2) ordinate dalle prime e più remote alle ultime e più recenti.
Il contesto italiano
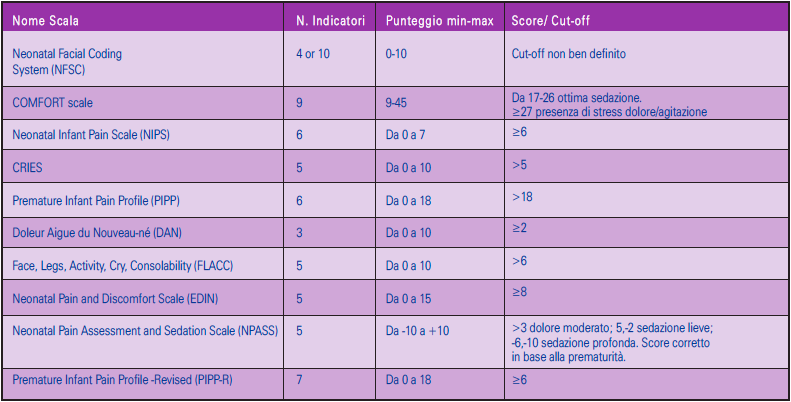
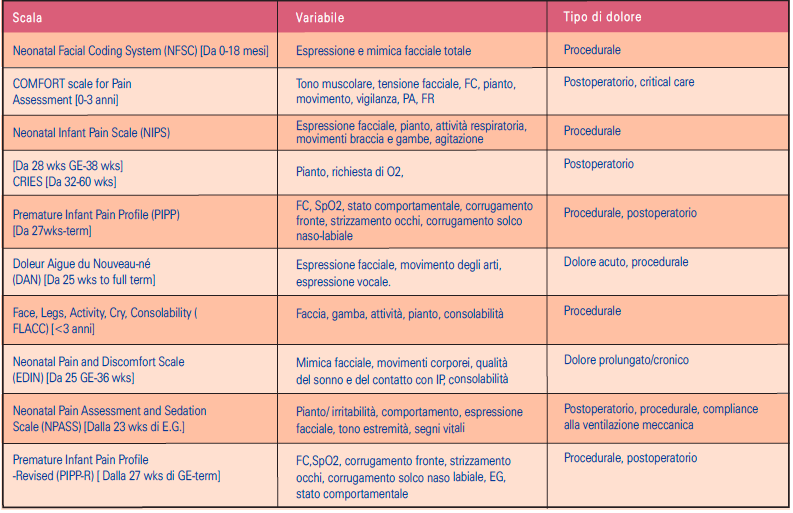
Esistono ad oggi molte scale e metodi di accertamento del dolore nel neonato. Dalla revisione non sono emersi veri e propri studi di validazione in lingua italiana delle scale. Tuttavia il Ministero della salute ha emanato un documento dal titolo ‘Il dolore nel bambino’ dove viene incoraggiato l’utilizzo delle scale PIPP, N-PASS, NIPS, FLACC, tradotte in lingua italiana.
Le scale valide e affidabili sono utili strumenti di accertamento del dolore nel neonato da utilizzare in base al contesto clinico (paziente in respiro spontaneo, sedato o in ventilazione meccanica). La Società Italiana di Neonatologia, nel documento Linee guida per la prevenzione e il trattamento del dolore nel neonato (www.neonatologia.it) ha riportato in lingua italiana le scale PIPP, NIPS, DAN, EDIN, oltre a una versione rivista per la scala PIPP, (PIPP-R). In una rassegna dal titolo Neonatal pain assessment scales: A review, sono tradotte la Comfort scale, la NFCS e la CRIES.
Le scale sono elencate nelle Tabelle 4 e 5 e sono suddivise in strumenti per l’accertamento unidimensionale e multidimensionale:
➢ la scala NFCS, Neonatal Facial Coding System (16), è una scala unidimensionale che si fonda sull’osservazione del comportamento facciale, un sistema per la codifica delle azioni facciali che descrive tutti i movimenti resi possibili dalla conformazione anatomica dei muscoli mimici (17, 18).
➢ La scala DAN, Douleur Aigue du Nouveau-nè (19), validata da Carbajal et al. nel 1997, è una scala unidimensionale che valuta il dolore nella fase acuta del sintomo. Utilizza tre indicatori comportamentali (espressione facciale e vocale e movimenti degli arti). Si utilizza per neonati sia a termine che a pretermine.
➢ La scala EDIN (Echelle de Douleur et d’Inconfort du Nouveau-né) (20) è stata concepita per la valutazione del dolore prolungato; strumento unidimensionale, per la sua messa a punto gli autori hanno utilizzato solamente parametri comportamentali, desunti dall’osservazione di neonati in diverse situazioni (21). È stata validata su 76 neonati prematuri, con un’età gestazionale media di 31 settimane.
➢ La scala FLACC, Face, Legs, Activity, Cry, Consolability (22), anch’essa unidimensionale, è stata messa a punto con lo scopo di fornire a medici e infermieri un metodo semplice per identificare, documentare e valutare il dolore prolungato nel paziente in età pre-verbale. Nonostante il manuale del Ministero della Salute, raccomandi di impiegarla nella valutazione del dolore in soggetti di età inferiore ai tre anni, includendo così anche l’epoca neonatale, la sua validazione è avvenuta su un campione di 89 bambini di età compresa tra due mesi e sette anni, sottoposti a diverse procedure chirurgiche (22-24).
➢ La scala Comfort (25), disegnata per la Terapia Intensiva Pediatrica e/o Neonatale, dà una misura del dolore affidabile e valida, non invasiva, multidimensionale e adatta per l’osservazione continuativa. Sono state inserite otto variabili, perché esse sono comunemente usate in ambito clinico, si modificano rapidamente, possono essere valutate in modo semplice e non invasivo e riflettono lo stress sperimentato in Terapia Intensiva (il campione degli studi di validazione era costituito da 37 soggetti di età compresa tra 0 e 204 mesi). È molto affidabile per la valutazione del livello di sedazione, poiché si correla con il bispectral index (valore ricavato da parametri elettroencefalografici) e la latenza media dei potenziali evocati uditivi.
➢ La scala CRIES, Crying, Requires O2, Increased vital signs, Expression, Sleepless (26, 27), è stata validata con l’obiettivo di sviluppare uno strumento articolato in punti come l’indice di Apgar. La CRIES è risultata una buona scala di valutazione del dolore in quanto, in occasione di diverse manovre dolorose eseguite nel periodo postoperatorio su un campione di 24 neonati di età compresa tra 32 settimane di gestazione (EG) e 60 settimane, e si correla sia con la valutazione soggettiva degli infermieri sia con la scala Objective Pain Scale (26).
➢ La scala PIPP, Premature Infant Pain Profile (28) è una scala di valutazione del dolore nel neonato pretermine. Il valore della scala PIPP viene aggiustato in base alla prematurità del neonato (29, 30).
➢ La scala Neonatal Infant Pain Scale, acronimo NIPS (31) è una scala di valutazione non invasiva, oggettiva, che fornisce una misura globale dell’intensità del dolore. Essa è dotata di elevata concordanza nei punteggi dati da due diversi osservatori, elevata correlazione con la scala analogica visiva ed elevata omogeneità dei sei componenti dello score.
➢ La scala Neonatal Pain Agitation and Sedation Scale, acronimo N-PASS (32), è uno strumento per l’accertamento del dolore nel neonato specifico per la terapia intensiva neonatale. Un recente studio su 218 neonati con età media di 34 settimane di EG ricoverati in TIN ha dimostrato che la scala N-PASS riesce a rilevare un’obiettiva misurazione di dolore, agitazione e sedazione, in accordo significativo con la percezione che gli infermieri hanno del livello di dolore osservato nel neonato.
➢ La scala Premature Infant Pain Profile Revised, acronimo PIPP-R (30), è stata proposta nel 2014 da Stevens et al., per semplificare il calcolo del punteggio della scala PIPP. Questo strumento considera i correttivi contestuali solo per punteggi superiori a 0. L’applicazione della scala prevede un periodo di osservazione di 15 secondi e poi la rilevazione delle modifiche degli indicatori-items per 30 secondi dopo lo stimolo doloroso.
Discussione
Il termine neonato, letteralmente nuovo nato è un termine ibrido e nel bambino questo periodo corrisponde ai primi ventotto giorni di vita. Dall’inizio del secondo mese allo svezzamento, riferendosi al regime alimentare dominante, il bambino viene definito “lattante” (1, 2). La maggiore difficoltà nella valutazione del dolore nel neonato è che il paziente è pre-verbale e quindi non può comunicare il proprio dolore. Gli studi emersi dalla letteratura hanno tentato, pertanto, di creare strumenti atti a individuare alcune variabili dipendenti che si modificano in modo univoco, costante e possibilmente anche proporzionale allo stimolo doloroso. Risultato ne sono le scale algometriche neonatali (11, 21), scale che prendono in considerazione le modificazioni fisiologiche e comportamentali indotte dal dolore (12-14). Sono state elaborate scale di tipo unidimensionale (che usano parametri fisiologici o parametri comportamentali) e di tipo multidimensionale (che usano insieme parametri fisiologici e comportamentali). Le caratteristiche di una scala ottimale sono caratteristiche scientifiche quali validità, affidabilità, riproducibilità, sensibilità e specificità, praticità d’impiego e semplicità mnemonica.
Molte scale sono state validate, ma nessuna è stata adottata universalmente o risulta essere superiore alle altre (11). A differenza dell’adulto, dove le raccomandazioni internazionali invitano i professionisti a non utilizzare i parametri vitali come indicatori algometrici (33), nel neonato sono diversi gli strumenti validati che utilizzano questi parametri (FC, PA, SpO2), per accertare una condizione di disagio o di stress che deve indurre a pensare la presenza di dolore. Non esiste un gold standard, bisogna considerare il paziente che si ha di fronte e scegliere la scala più adatta per poter affrontare il dolore nel miglior modo possibile (15).
Se vogliamo trattare il dolore in modo efficace, è necessario misurarlo, cioè renderlo quantificabile utilizzando strumenti adeguati, efficaci e validati dalla letteratura. La raccolta dell’anamnesi prevede la valutazione della storia familiare e patologica remota e prossima, con domande rivolte direttamente al bambino (quando possibile per età e patologia) e/o ai genitori (10). Nel neonato ciò non è possibile. È importante mettere in luce precedenti esperienze dolorose e risposte messe in atto, descrizione del dolore attuale (sede, andamento, situazioni esacerbanti e limitanti, risposta ai farmaci) e modificazione del ritmo circadiano e della qualità della vita.
Un sistema rapido per memorizzare quali caratteristiche del dolore occorre cercare è il sistema PQRST, acronimo di Provocazione, Qualità, iRradiazione, Severità, Tempo. Le conoscenze scientifiche degli ultimi anni hanno aggiunto sempre più consistenti evidenze che il neonato, anche se pretermine, è molto sensibile allo stimolo nocicettivo a cui risponde con una reazione fisiologica e comportamentale ben evidente e con una cascata ormonale e metabolica, il cui ripetersi può comportare effetti destabilizzanti a breve e medio termine (33). Questa vulnerabilità e fragilità allo stimolo doloroso soprattutto del neonato pretermine sono spiegabili dal punto di vista neurofisiologico con il fatto che, nonostante un apparato sensoriale per la nocicezione ben sviluppato a partire dal secondo trimestre di gravidanza, i sistemi discendenti inibitori e i loro neurotrasmettitori preposti alla modulazione delle afferenze nocicettive sono deficitari ed immaturi fino anche a dopo la nascita a termine (34). Esistono inoltre sempre più segnalazioni sugli effetti a lungo termine di una esposizione precoce e ripetitiva a stimolazioni nocicettive in un momento così delicato e fondamentale per lo sviluppo del sistema nervoso. Sono state evidenziate modificazioni comportamentali a distanza di tempo e riduzioni di volume delle aree cerebrali sensitive in ex pretermine ricoverati in TIN, simili a quelle evidenziate nel modello sperimentale di ratto di pari età gestazionale, sottoposto a stimoli dolorosi precoci e reiterati (35,36). Nonostante queste evidenze accumulate, il trattamento del dolore da procedura rimane attualmente limitato nel neonato. Ci sono dati che riportano come un neonato ricoverato in TIN viene sottoposto in media a 14 procedure dolorose al giorno (37). A tal proposito è importante sensibilizzare il personale medico ed infermieristico e formarlo ad una migliore gestione del dolore implementando strumenti di valutazione reperibili in letteratura ed incrementando l’inserimento di linee guida e protocolli operativi. Da una recente indagine epidemiologica sulle pratiche di analgesia e sedazione svolta dal Gruppo di Studio (GdS) di Analgesia e Sedazione nel Neonato presso le TIN Italiane, emerge che i centri che hanno prodotto delle proprie linee guida scritte sono la minoranza e che un adeguato controllo del dolore viene eseguito in maniera incostante e variabile a seconda della procedura e dell’operatore (38).
Conclusione
Pur con i limiti della revisione narrativa che non ha utilizzato un approccio sistematico, al momento non esiste uno strumento migliore o che rappresenti il gold standard nell’accertamento del dolore in Terapia Intensiva Neonatale. La maggiore difficoltà nel valutare il dolore nel neonato è che il piccolo paziente è in una fase pre-verbale ed è quindi utile sensibilizzare e formare gli operatori sanitari all’utilizzo corretto di tecniche di accertamento. Le linee guida internazionali incoraggiano fortemente l’utilizzo di strumenti validati per l’accertamento del dolore nei soggetti incapaci a comunicare (39). Gli infermieri rappresentano la categoria professionale che trascorre più tempo con il paziente sia in Terapia Intensiva sia nelle strutture successive, pertanto sono i professionisti che maggiormente devono essere in grado di intercettare tempestivamente le algie e le condizioni di discomfort al fine di fornire un adeguato trattamento.
Bibliografia
1. Anand KJS, Stevens BJ, McGrath PJ. Pain in neonates. 2nd ed. Amsterdam: Elsevier, 2000.
2. Anand KJS, Carr DB. The neuroanatomy, neurophysiology and neurochemistry of pain, stress and analgesia in newborns and childrens. Pediatr Clin North Am 1989; 36: 795-821.
3. Anand KJ, Hickey PR. Pain and its effects in the human neonate and fetus. N Engl J Med 1987; 317: 1321-9.
4. Bhutta AT, Anand KJ. Vulnerability of the developing brain. Neuronal mechanisms. Clin Perinatol 2002; 29: 357-72.
5. Buskila D, Neumann L, Zmora E. Pain sensitivity in prematurely born adolescents. Arch Pediatr Adolesc Med 2003; 157: 1079-1082.
6. Anand KJ. Pain assessment in preterm neonates. Pediatrics 2007; 119: 605-607.
7. Gibbins S, Stevens B, Asztalos E. Assessment and management of acute pain in high-risk neonates. Expert Opin Pharmacother 2003; 4: 475-483;
8. Walker SM, Franck LS, Fitzgerald. Long-term impact of neonatal intensive care and surgery on somatosensory perception in children born extremely preterm. Pain 2009; 141; 79-87.
9. Lago P, Garetti E, Merazzi D. Guidelines for procedural pain in the newborn. Acta Paediatr 2009; 98(6): 932–9. doi:10.1111/j.1651-2227.2009.01291.
10. Cimerman P, Anand KJ, Bréart G. Epidemiology and treatment of painful procedures in neonates in intensive care units. JAMA 2008; 300(1): 60–70.
11. Martins de Melo G, de Aguiar Lélis ALP, Falconieri de Moura A, Moreira Leitão Cardoso MVL, Martins da Silva V. Pain assessment scales in newborns: integrative review. Rev Paul Pediatr 2014; 32(4): 395-402. doi: 10.1016/j.rpped.2014.04.007.
12. Belville RG, Seupaul RA. Pain measurement in pediatric emergency care: a review of the faces pain scale-revised. Pediatr Emerg Care 2005; 21(2): 90-93.
13. Stinson JN, Kavanagh T, Yamada J, Gill N, Stevens B. Systematic review of the psychometric properties, interpretability and feasibility of self-report pain intensity measures for use in clinical trials in children and adolescents. Pain 2006; 125 (1-2): 143-157.
14. Hummel P, Lawlor-Klean P, Weiss MG. Validity and reliability of the N-PASS assessment tool with acute pain. Journal of Perinatology 2010; 30: 474-478 doi:10.1038/jp.2009.185.
15. Sharek PJ, Powers R, Koehn A, Anand KJ. Evaluation and development of potentially better practices to improve pain management of neonates. Pediatrics 2006; 118 (Suppl 2): S78.
16. Grunau RVE,Craig KD. Pain expression in neonates: facial action and cry. Pain 1987; 28: 395-410.
17. Grunau RVE, Craig KD. Facial activity as a measure of neonatal pain expression. In: Tyler DC Krane EJ (eds). Advances in Pain Research and Therapy. Volume 15. New York: Raven Press 1990: 147-155.
18. Grunau RE, Oberlander T. Bedside application of the Neonatal Facial Coding System in pain assessment of premature neonates. Pain 1998; 76: 277-286.
19. Carbajal R, Paupe A, Hoenn E, Lenclen R, Olivier-Martin M. DAN: une échelle comportamentale d’évalutation de la douler aigue du nouveau-né. Arch Pèdiatr 1997; (4): 623-628.
20. Debillon T, Zupan V, Ravault N, Magny JF, Dhan M. Development and initial validation of the EDIN scale, a new tool for assessing prolonged pain in preterm infants. Arch Dis Child Fetal Neonatal Ed. 2001; 85: F36-41.
21. Ancora G, Mastrocola M, Bagnara C, Zola D, Pierantoni L, Rossi G, Corvaglia L, Faldella G. Influence of gestational age on the EDIN score: an observational study. Arch Dis Child Fetal Neonatal Ed 2009; 94(1): F35-38.
22. Merkel S, Voepel-Lewis T, Shayevitz JR, Malviya S. The FLACC: A behavioural scale for scoring postoperative pain in young children. Pediatric Nursing 1997; 23: 293-297.
23. Merkel S, Voepel-Lewis T, Malviya S. Pain assessment in infants and young children: the FLACC scale. Am J Nurs 2002; 102(10): 55–8.
24. Malviya S, Vopel-Lewis T, Burke C, et al. The revised FLACC observational pain tool: improved reliability and validity for pain assessment in children with cognitive impairment. Paediatr Anaesth 2006; 16: 258-65.
25. Ambuel B, Hamlett KW, Marx CM, Blumer JL. Assessing distress in pediatric intensive care environments: the COMFORT scale. J Pediatr Psychol 1992; 17(1): 95-109.
26. Krechel, SW, Bildner, J. CRIES: A new neonatal postoperative pain measurement score. Initial testing of validity and reliability. Paediatric Anaesthesia 1995; 5: 53-61.
27. Bildner, J, Krechel, SW. Increasing Staff Nurse Awareness of Postoperative Pain Management in the NICU. Neonatal Network 1996; 15(1):11-16.
28. Stevens B, Johnston C, Petryshen P, Taddio A. Premature infants pain profile (PIPP): development and initial validation. Clin J Pain 1996;12:13-22.
29. Stevens B, Harrison D, Rashotte J, Yamada J, Abbott LK, Coburn G, Stinson J, Le May S and CIHR Team in Children’s Pain. Pain assessment and intensity in hospitalized children in Canada. J Pain 2012;13: 857-865.
30. Stevens BJ, Gibbins S, Yamada J, Dionne K, Lee G, Johnston C, Taddio A. The Premature Infants Pain Profile-Revised (PIPP-R): Initial Validation and Feasibility. Clin J Pain 2014; 30: 238243
31. Lawrence J, Lacock D, McGrath, Kay J, MacMurray SB, Dilberg C.The development of a tool to assess neonatal pain (NIPS). Neonatal Netw 1993; 12(6): 59-66.
32. Hummel P, Puchalski M, Creech SD, Weiss MG. Clinical reliability and validity of the N-PASS: neonatal pain, agitation and sedation scale with prolonged pain. J Perinatol 2008; 28: 55-60.
33. Barr J, Fraser GL, Puntillo K, Ely E W, Gelinas C, et al. Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit: Executive summary. Am J Health-Syst Pharm2013; 70(1): 53–58.
34. Anand KJS, Scalzo FM. Can adverse neonatal experience alter brain development and subsequent behavior? Biol Neonate 2000; 77: 69-82.
35. Grunau RVE. Long-term consequences of pain in human neonates. In Anand JKS, Stevens BJ, McGrath PJ Editors Pain in neonates. 3rd Edition. Amsterdam. Elsevier; 2007: 55-76.
36. Peterson BS, Vohr B, Staib LH, Cannistraci CJ, Dolberg A, Schneider KC, Katz KH, Westerveld M, Sparrow S, Anderson AW, Ducan CC, Makuch RW, Gore JC, Ment LR. Regional brain volume abnormalities and long-term cognitive outcome in preterm infants. JAMA 2000; 284: 1939-1947.
37. Simons SHP, Van Dijk M, Anand KS, Roothhooft D, van Lingen RA, Tibboel D. Do we still hurt newborn babies? A prospective study of procedural pain and analgesia in neonates. Arch Pediatr Adolesc Med 2003; 157: 1058-1064.
38. Lago P, Guadagni AM, Merazzi D, Ancora G, Bellieni CV, Cavazza A. Pain Management in the Neonatal Intensive Care Unit: a National Survey in Italy. Pediatric Anesthesia 2005; 15: 925-931.
39. Herr K, Coyne PJ, Key T, Manworren R, McCaffery M, Merkel S, Pelosi-Kelly J, Wild L. Pain Assessment in the Nonverbal Patient: Position Statement with Clinical Practice Recommendations. Pain Manag Nurs 2006; 7(2): 44–52. doi: 10.1016/j.pmn.2006.02.003.
