Introduzione
Il dolore è tra i motivi che più frequentemente inducono il paziente anziano a rivolgersi al medico (1-3). La ragione, tuttavia, non sembra essere un aumento della prevalenza del dolore con l’aumentare dell’età, ma piuttosto un aumento del dolore associato a disabilità, malattie croniche, fragilità, cadute e altri problemi dell’invecchiamento (4). Nei Paesi industrializzati già negli adulti con età superiore a 50 anni si instaura una correlazione diretta tra dolore e malattie croniche e tra dolore e multimorbidità (5). Queste associazioni si intensificano col tempo e tra gli anziani più dei due terzi sono affetti da malattie croniche multiple, una prevalenza sovrapponibile a quella del dolore persistente (3,6). A conferma di queste evidenze, la prevalenza del dolore negli anziani che vivono nelle strutture socio-sanitarie residenziali è consistentemente più elevata di quella dei coetanei che vivono in comunità (3,6-7).
La gestione del dolore nell’anziano è tuttora ardua per le numerose problematiche irrisolte che vanno dalla difficoltà di diagnosi, alla sostanziale carenza di studi clinici, alla assoluta insufficienza di terapie efficaci e sicure (8 9). Di conseguenza, spesso il dolore negli anziani non viene né ben riconosciuto né adeguatamente trattato (4,9). La valutazione del dolore nell’anziano è resa complessa dalla frequente concomitanza di condizioni cliniche cronicizzate, dalla presenza di cause multiple di dolore (10) e dalle multiterapie in atto, che possono interferire con i meccanismi del dolore. L’uso delle scale di valutazione è poi complicato dalla presenza di deficit visivi e uditivi, oltre che da disturbi cognitivi (4,11). Nonostante gli anziani siano i maggiori utilizzatori di farmaci analgesici, è esiguo il numero di trial randomizzati e controllati finalizzati alla determinazione dell’efficacia e della sicurezza di queste terapie nel paziente anziano (12,13). Inoltre, va considerato che le terapie analgesiche disponibili per il dolore cronico e neuropatico nel soggetto adulto risultano efficaci in meno del 50% dei casi e la remissione del dolore è solitamente solo parziale (14).
La gestione del dolore cronico nell’anziano costituisce per il clinico una sfida che potrà essere vinta solo utilizzando strategie terapeutiche innovative basate sia sulla conoscenza delle reali esigenze del paziente, che delle differenze nella percezione ed elaborazione del dolore, nonché delle variazioni legate all’invecchiamento, come ad esempio le alterazioni del sistema immunitario, che sono in grado di modificare la responsività agli stimoli dolorosi.
Cambiamenti del sistema somatosensoriale del dolore nell’anziano
La soglia del dolore, cioè la capacità del sistema somatosensoriale di riconoscere e captare uno stimolo doloroso, soprattutto nelle donne, aumenta con l’età (15,16), un risultato confermato dalla risonanza magnetica funzionale (17). L’alterazione oggi può essere in parte attribuita alla progressiva compromissione delle fibre del dolore Aδ (18). Quindi, come per altre funzioni sensoriali quali vista ed udito, con l’età diminuisce la capacità di captare segnali nocivi per l’organismo (presbyalgos). In contrasto, la soglia di tolleranza al dolore rimane inalterata o diminuisce con l’età (15,19). I dati indicano che gli anziani sottovalutano le stimolazioni a bassa intensità, ma sopravvalutano quelle ad alta intensità e, in altre parole, una volta percepito, il dolore può diventare rapidamente intollerabile. Questa incapacità di riconoscere correttamente i segnali pericolosi contribuisce probabilmente all’aumento degli incidenti tra gli anziani e, indirettamente ad accrescere la prevalenza del dolore in questa popolazione (20). Altri cambiamenti importanti nel sistema del dolore degli anziani riguardano i sistemi di modulazione endogena del dolore: una minore capacità inibitoria, e a volte una facilitazione dei processi dolorosi, è stata costantemente osservata nelle persone anziane sane (21,22) associata ad un’aumentata predisposizione allo sviluppo della sensitizzazione centrale (3).
Questa scarsa capacità di modulare i processi dolorosi contribuisce alla maggiore vulnerabilità nello sviluppo del dolore cronico dopo infortuni o malattie dell’anziano (23). I sistemi endogeni di modulazione del dolore sono, inoltre, alterati dalla presenza di malattie concomitanti.
Alterazioni che coinvolgono il sistema immunitario nell’anziano
Nel dolore cronico il sistema somatotosensoriale non è unico protagonista in scena. R. Thurman (24) ha provato a definire la complessa natura del dolore cronico come: “…una grave malattia, molto diffusa, incompresa, sottodiagnosticata, e non trattata…, è solo negli ultimi anni che il dolore cronico comincia ad essere considerato una condizione neuropatologica; il dolore non trattato può “riscrivere” il sistema nervoso centrale, causando alterazioni encefaliche e spinali patologiche, che amplificano il dolore stesso…”
Negli anziani, il dolore cronico è ancora più complesso per i molteplici cambiamenti che progressivamente colpiscono il sistema immunitario. Le cellule immunitarie, in particolare mastociti e microglia, sono co-protagoniste del sistema somatosensoriale nel facilitare l’insorgenza del dolore cronico. Mastociti e microglia sono interlocutori primari dei neuroni del dolore, sia in periferia che a livello spinale e sovra spinale e ogni loro cambiamento promuove processi di neuroinfiammazione persistente che si ripercuotono sulla funzionalità dei neuroni.
Mastociti e microglia con l’età cambiano la propria reattività
In generale, la densità dei mastociti nei tessuti dell’anziano è spesso alterata per l’alterata produzione di fattori che ne promuovono o inibiscono la maturazione da parte delle cellule stromali residenti (25). Non sembra, invece, essere modificata la produzione dei precursori mastocitari (25). In diversi tessuti con l’invecchiamento si osserva una diminuzione nella maturazione dei mastociti, tuttavia queste cellule mostrano un’aumentata sensibilità verso i mediatori infiammatori e un aumentato stato di degranulazione (26,27). In altri tessuti, la densità mastocitaria aumenta con l’età (28,29). In particolare, nel compartimento endoneurale si osserva un reclutamento di cellule non-neuronali, tra cui i mastociti, indotto probabilmente dalle fibre neuronali danneggiate. L’aumento di mastociti endoneurali e la loro progressiva ipersensibilità con l’invecchiamento sicuramente contribuiscono alla determinazione delle alterazioni percettive e funzionali dei neuroni somatosensoriali primari. I mastociti endoneurali iperattivi possono, inoltre, attraverso il release non controllato di enzimi proteolitici, concorrere direttamente alla progressiva compromissione delle fibre del dolore Aδ (18).
Come i mastociti anche la microglia, principale cellula immunitaria residente nel CNS, modifica con l’età le proprie capacità ricettive e reattive (30). In condizioni fisiologiche la microglia è presente nel tessuto cerebrale nella sua forma ramificata o fenotipo quiescente ma, se stimolata, può rapidamente assumere il fenotipo attivato o pro-infiammatorio. Generalmente l’attivazione fisiologica della microglia porta alla risoluzione della neuroinfiammazione e al ripristino dell’omeostasi tessutale. Nell’invecchiamento la microglia è presente prevalentemente in un fenotipo definito primed. La risposta della microglia primed a uno stimolo è più intensa, cioè le citochine pro-infiammatorie prodotte sono di più e l’iper-produzione dura per molto tempo. La microglia primed causa, per questo, neuroinfiammazione persistente, capace di danneggiare l’integrità del tessuto e la funzionalità dei neuroni (Figura 1) (31).
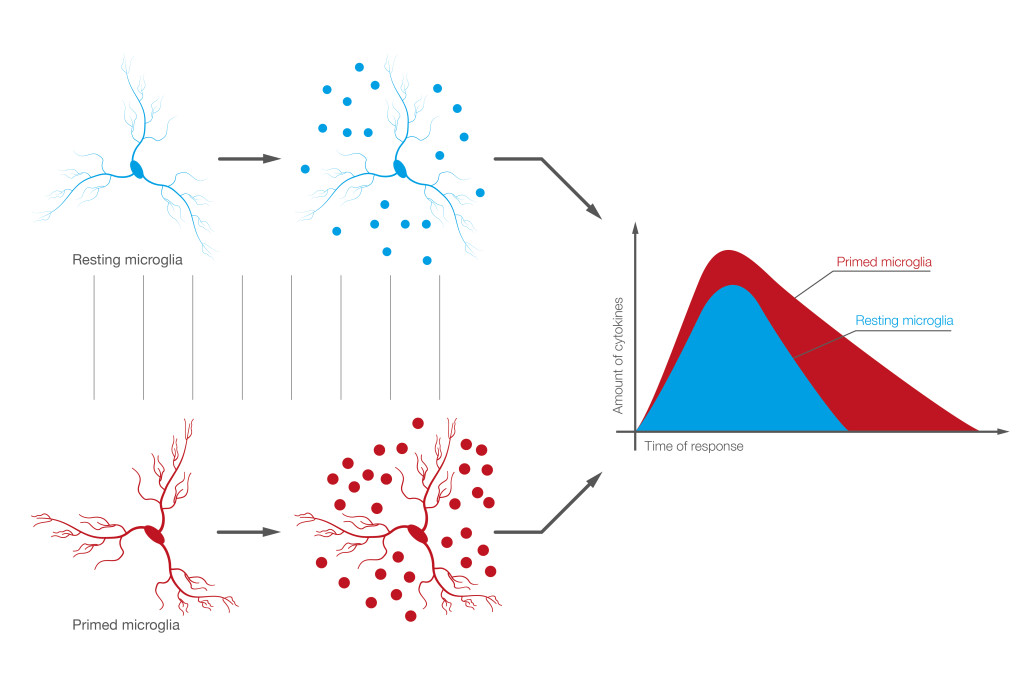
La microglia dell’anziano è sensibilizzata agli stimoli che ne provocano l’attivazione ed insensibile ai sistemi endogeni di regolazione omeostatica (32). La microglia primed presente nel midollo spinale e nei nuclei talamici del dolore, attraverso un’eccessiva risposta alle stimolazioni dolorose periferiche, facilita l’insorgenza del dolore cronico e/o neuropatico. La microglia primed può anche promuovere l’insorgenza del dolore in assenza di stimoli periferici (dolore centrale). L’eccesso di citochine pro-infiammatorie prodotte dalla microglia primed può agire a più livelli per influenzare negativamente i processi del dolore. L’azione diretta sui neuroni somatosensoriali di secondo e terzo ordine può causare uno stato di ipereccitabilità neuronale (sensitizzazione centrale) (33). Le citochine pro infiammatorie possono, inoltre, danneggiare l’integrità della sostanza bianca e l’ultrastruttura della guaina mielinica. Una diminuzione delle proteine mieliniche è stata, infatti, messa in correlazione con un’aumentata attivazione gliale (34). Questi risultati sono in linea con le osservazioni relative a cambiamenti età-dipendenti delle fibre mielinizzate del dolore di tipo Aδ e non quelle amieliniche di tipo C (18).
L’alterata reattività dei mastociti e della microglia negli anziani emerge prepotentemente anche come fattore di condivisione, o forse come promotore, della low grade inflammation o non resolving inflammation, caratteristica delle malattie croniche e del dolore cronico (5,35,36). Si tratta di un aumento cronico, sistemico, sebbene spesso non imponente, dei livelli di mediatori pro-infiammatori come TNF-α, IL-1, IL-6, ecc. (37). I mediatori pro-infiammatori, alcuni dei quali vasoattivi, altri neurotossici, ecc. oltre ad agire sulle terminazioni nervose somatosensoriali possono aumentare la permeabilità della barriera emato spinale permettendo alle sostanze tossiche di penetrare nel parenchima spinale ed agire direttamente sulla microglia attivandola, amplificando i processi del dolore (sensitizzazione centrale), favorendo l’insorgenza della neuroinfiammazione spinale e della conseguente neurodegenerazione. Tra le malattie croniche caratterizzate da low grade inflammation con maggiore criticità per l’insorgenza e/o la progressione del dolore cronico sono inclusi sia i disturbi dell’umore quali ansia e depressione, che possono essere sia causa scatenante che conseguenza del dolore cronico (23,38), che le malattie neurodegenerative associate a disturbi neurocognitivi. Questi, ostacolando la diagnosi del dolore, ne impediscono trattamento e risoluzione (39,40).
I pazienti con dolore cronico, compresi quelli senza una storia di disturbi neurologici, manifestano frequentemente deficit cognitivi che si ripercuotono negativamente sui rapporti sociali e sulla vita quotidiana. Molti domini cognitivi come l’attenzione, la capacità di concentrazione, la velocità di elaborazione, la memoria, la capacità psicomotoria, il processo decisionale e le funzioni esecutive sono influenzati negativamente dal dolore. D’altra parte, le sindromi con dolore cronico sono associate negativamente ai processi dell’attenzione e della memoria (41). Nelle condizioni caratterizzate da dolore cronico e da disturbi neurocognitivi, la low grade inflammation diviene, pertanto, l’elemento di congiunzione e di amplificazione di entrambe le condizioni. Infatti, non solo i neuroni somatosensoriali periferici, spinali e sovra spinali possono essere danneggiati da un’attivazione persistente del sistema immunitario, ma anche le popolazioni neuronali coinvolte nelle più comuni patologie neurodegenerative (35).
Gestione del dolore nel paziente anziano
È fondamentale che il dolore degli anziani sia adeguatamente trattato sia per garantire una dignitosa qualità della vita che per evitare incidenti domestici e/o l’insorgenza di altre malattie (4,42). Il dolore non adeguatamente controllato è tra i principali promotori dei disturbi dell’umore (23,38,43,44) e del sonno (45,46).
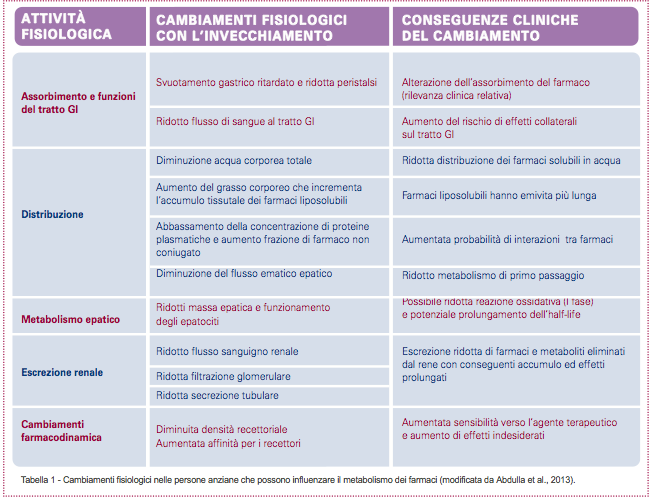
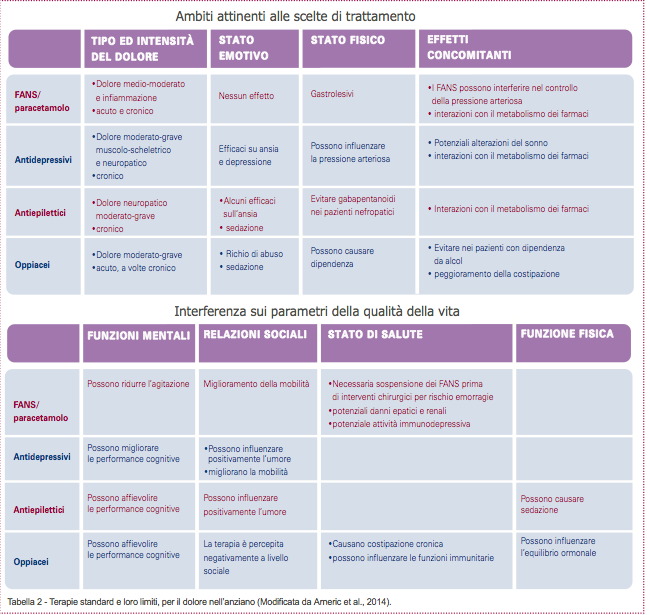
È, inoltre, fondamentale che il dolore cronico e/o neuropatico degli anziani sia trattato con terapie che tengano conto delle progressive variazioni fisiologiche che si sviluppano con l’avanzamento dell’età (Tabella 1), che presentino un elevato profilo beneficio/rischio; che risultino idonee a trattamenti cronici; che non interferiscano con le poli-terapie farmacologiche cui gli anziani stessi sono necessariamente sottoposti.
Purtroppo, nessuna delle terapie standard attualmente disponibili per il dolore degli anziani è adatta a trattamenti prolungati (Tabella 2). Tuttavia il dolore cronico e/o neuropatico risulta essere la forma di dolore con più alta prevalenza in questa popolazione. È quindi inevitabile che il profilo beneficio/rischio della maggior parte delle terapie sia sbilanciato a favore dei rischi con l’aumentare del tempo di trattamento. Per questo, le linee guida per la gestione del dolore nelle persone anziane suggeriscono di usare farmaci anti-infiammatori non steroidei (FANS) con molta cautela, alla dose più bassa e per la durata più breve (48). Gli anziani che assumono FANS devono essere monitorati routinariamente per potenziali rischi gastrointestinali ed epatici, per effetti collaterali renali e cardiovascolari e per interazioni tra farmaci. L’uso degli antidepressivi triciclici e degli antiepilettici è fortemente limitato per la scarsa tollerabilità e per gli importanti effetti indesiderati (48). Le terapie con oppioidi agiscono, oltre che sui neuroni, anche sulle cellule non-neuronali come microglia, astrociti e mastociti, attivandole e promuovendo ulteriormente lo sviluppo della neuroinfiammazione (49,50). Importanti effetti collaterali di queste terapie sono, infatti, imputabili proprio all’attivazione delle cellule non-neuronali (51).
Le acquisizioni più recenti suggeriscono che le cellule non-neuronali possano costituire importanti target terapeutici per il trattamento del dolore cronico e/o neuropatico sia nell’adulto che nell’anziano. In particolare, destano particolare interesse le molecole in grado di normalizzarne l’attivazione in modo da limitare lo sviluppo dei processi di neuroinfiammazione bloccando la cascata di eventi che favorisce l’insorgenza delle alterazioni dei neuroni somatosensoriali e facilita l’insorgenza della sensitizzazione centrale. Tra le molecole in grado di modificare il decorso della malattia o disease-modifying agent desta particolare interesse la palmitoiletanolamide (PEA) (52). La PEA è una N-aciletanolamina endogena prodotta on demand per favorire i processi di risoluzione della neuroinfiammazione e del dolore (53-55). La PEA, opportunamente formulata con tecniche farmaceutiche innovative che consentano di ottenere dimensioni particellari microniche o submicroniche (PEA micronizzata, ultramicronizzata), somministrata esogenamente è in grado di:
• controllare la reattività dei mastociti periferici tissutali ed endoneurali, normalizzando la sensitività e la funzione dei neuroni somatosensoriali primari periferici;
• agire sulle cellule non-neuronali spinali e sovraspinali (microglia, mastociti residenti o infiltranti, astrociti) per contrastare i processi di neuroinfiammazione e normalizzare l’attività dei neuroni somatosensoriali secondari e terziari (55).
Numerosi studi preclinici hanno dimostrato le capacità della PEA di ridurre i processi infiammatori e il dolore indotti da vari stimoli acuti (56). L’effetto della somministrazione di PEA per diverse vie è dose dipendente (57-61) e gli effetti antinfiammatori e antidolorifici della PEA sono stati confermati nei modelli di infiammazione cronica (62) e dolore cronico o dolore neuropatico (63-67). In questi modelli, il trattamento cronico con PEA oltre a ridurre il dolore è in grado di preservare la morfologia del nervo periferico, ridurre l’edema endoneuronale, il reclutamento e l’attivazione delle cellule mastocitarie e la produzione di mediatori proinfiammatori nel sito di danno (64,65). Nei modelli di dolore neuropatico, la PEA riduce l’attivazione microgliale nel midollo spinale ed aumenta la produzione della citochina antinfiammatoria IL-10.
Nell’uomo la PEA nelle forme micronizzata e ultramicronizzata, come dimostrato da diversi studi clinici, riduce il dolore cronico e quello neuropatico associati a diverse condizioni patologiche, incluse quelle associate a neuroinfiammazione centrale (52) [download#18] . La riduzione del dolore è associato alla riduzione delle disabilità funzionali (68-73) e a un calo nell’uso di farmaci analgesici (71,74). In caso di neuropatia periferica indotta dai chemioterapici talidomide/bortezomib, il trattamento cronico con PEA micronizzata oltre a ridurre la sintomatologia dolorosa migliora le funzioni neurofisiologiche delle fibre mieliniche (75). Le capacità della PEA di migliorare i parametri elettrofisiologici sono state osservate anche nella sindrome del tunnel carpale (71), anche quando presente in pazienti diabetici (76). La PEA non induce tolleranza e la sua efficacia aumenta progressivamente con il tempo di trattamento (73, 77).
Negli studi in cui il trattamento con la PEA è associato a terapie standard per il dolore neuropatico (per es., carbamazepina, pregabalin e ossicodone) (69,70,78), l’effetto antidolorifico è osservato anche quando queste terapie venivano usate a dosaggi non terapeutici. Il risultato additivo o sinergico è probabilmente il riflesso dei diversi meccanismi d’azione esplicate dalle molecole delle terapie classiche, che agiscono prevalentemente sui neuroni, rispetto alla PEA, che agisce prevalentemente su cellule non neuronali, come mastociti e microglia.
Gli studi clinici che hanno impiegato PEA nelle forme micronizzata e ultramicronizzata hanno anche evidenziato che la molecola ha un elevato profilo beneficio/rischio, è idonea a trattamenti cronici, non interferisce con le terapie per altre patologie. Inoltre, la PEA, nelle forme micronizzata e ultramicronizzata, è esente da tossicità acuta e cronica (79). L’assunzione di PEA nelle forme micronizzata e ultramicronizzata non è associata a lesioni della mucosa gastrica. Queste sue caratteristiche hanno permesso di includere la PEA micronizzata ed ultramicronizzata in una nuova categoria di agenti terapeutici naturali chiamati Alimenti a Fini Medici Speciali (AFMS).
PEA: la dimensione particellare è fondamentale per l’efficacia terapeutica
La PEA è una molecola dotata di una importante attività farmacologica ma risulta scarsamente solubile in mezzi acquosi e difficile da formulare utilizzando approcci tradizionali. Questa molecola deve, quindi, essere necessariamente somministrata per via orale nelle forme micronizzata ed ultramicronizzata che presentano una ridotta dimensione particellare rispetto alle molecola non micronizzata. In particolare, la distribuzione granulometrica della PEA è nel range 2-10 micron nei prodotti contenti PEA micronizzata e 0.5-10 micron in quelli contenenti PEA ultramicronizzata (52, 95). La biodisponibilità della PEA dopo somministrazione esogena di PEA ultramicronizzata è stata recentemente riportata (96) ed è anche stata dimostrata la diretta correlazione tra i livelli ematici di PEA e l’attività farmacologica osservata. Un analogo profilo ematico della PEA è stato osservato nell’uomo (97): dopo un’ora dall’assunzione di PEA ultramicronizzata (1200 mg) si osserva un incremento dei livelli ematici di PEA di 9 volte rispetto al basale; i livelli di PEA rimangono molto alti a due ore, decrescono, rimanendo significativamente più alti a 4 ore e ritornano ai valori basali dopo sei ore dal trattamento.
Conclusioni
La gestione del dolore nell’anziano rimane una sfida aperta per il clinico. Nonostante l’elevata prevalenza, il dolore nell’anziano rimane sostanzialmente sottostimato e non adeguatamente trattato. Molteplici le motivazioni che determinano questo stato, a partire dal fisiologico declino che comporta una serie di alterazioni che coinvolgono i circuiti sensoriali e il sistema immunitario, in particolare i mastociti e la microglia, e alla limitata disponibilità di opzioni terapeutiche efficaci e sicure.
Tra le terapie innovative per il trattamento del dolore nell’anziano spicca la PEA per l’elevato rapporto efficacia/rischio, in quanto non induce tolleranza e non interferisce con altre potenziali terapie per il dolore e/o per le condizioni comorbide. Infine, la PEA può avere un’intrinseca efficacia su patologie croniche concomitanti con il dolore cronico, ad es. depressione ed ansia (80,81).
In conclusione, l’incremento progressivo della popolazione anziana nel mondo (82,83) e la consapevolezza del limitatissimo numero di studi sul dolore effettuati nella popolazione anziana (9) rafforzano la necessità di colmare le conoscenze mancanti e di orientare la scelta terapeutica verso gli strumenti innovativi adatti all’utilizzo cronico e che possano garantire efficacia, sicurezza e compatibilità con le multiterapie.
Ringraziamenti
Questa rassegna è parzialmente sostenuta dal progetto ministeriale PON01_02512.
Bibliografia
1. Hasselström J, Liu-Palmgren J, Rasjö-Wrååk G. Prevalence of pain in general practice. Eur J Pain. 2002; 6(5): 375-85.
2. Vos T, Flaxman AD, Naghavi M, Lozano R, Michaud C, Ezzati M, Shibuya K, Salomon JA, et al. Years lived with disability (YLDs) for 1160 sequelae of 289 diseases and injuries 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 2012; 380(9859): 2163-96.
3. Molton IR, Terrill AL. Overview of persistent pain in older adults. Am Psychol. 2014; 69(2): 197-207.
4. American Geriatrics Society Panel on the Pharmacological Management of Persistent Pain in Older Persons. Pharmacological management of persistent pain in older persons. J Am Geriatr Soc. 2009; 57(8): 1331-46.
5. Morrissey MB, Viola D, Shi Q. Relationship between pain and chronic illness among seriously ill older adults: expanding role for palliative social work. J Soc Work End Life Palliat Care. 2014; 10(1): 8-33.
6. Tsang A, Von Korff M, Lee S, Alonso J, Karam E, Angermeyer MC, Borges GL, Bromet EJ, Demytteneare K, de Girolamo G, de Graaf R, Gureje O, Lepine JP, Haro JM, Levinson D, Oakley Browne MA, Posada-Villa J, Seedat S, Watanabe M. Common chronic pain conditions in developed and developing countries: gender and age differences and comorbidity with depression-anxiety disorders. J Pain. 2008; 9(10): 883-91.
7. Won AB, Lapane KL, Vallow S, Schein J, Morris JN, Lipsitz LA. Persistent nonmalignant pain and analgesic prescribing patterns in elderly nursing home residents. J Am Geriatr Soc. 2004; 52(6): 867-74.
8. Gagliese L. Pain and aging: the emergence of a new subfield of pain research. J Pain. 2009; 10(4): 343-53.
9. Reid MC, Bennett DA, Chen WG, Eldadah BA, Farrar JT, Ferrell B, Gallagher RM, Hanlon JT, Herr K, Horn SD, Inturrisi CE, Lemtouni S, Lin YW, Michaud K, Morrison RS, Neogi T, Porter LL, Solomon DH, Von Korff M, Weiss K, Witter J, Zacharoff KL. Improving the pharmacologic management of pain in older adults: identifying the research gaps and methods to address them. Pain Med. 2011; 12(9): 1336-57.
10. Denkinger MD, Lukas A, Nikolaus T, Peter R, Franke S; for the ActiFE study group. Multisite pain, pain frequency and pain severity are associated with depression in older adults: results from the ActiFE Ulm study. Age Ageing. 2014. [Epub ahead of print]
11. Tracy B, Sean Morrison R. Pain management in older adults. Clin Ther. 2013; 35(11):1659-68.
12. Bayer A, Tadd W.Unjustified exclusion of elderly people from studies submitted to research ethics committee for approval: descriptive study. BMJ. 2000; 321(7267): 992-93.
13. Koponen MP, Bell JS, Karttunen NM, Nykänen IA, Desplenter FA, Hartikainen SA. Analgesic use and frailty among community-dwelling older people: a population-based study. Drugs Aging. 2013;30(2):129-36.
14. Mao J, Gold MS, Backonja MM. Combination drug therapy for chronic pain: a call for more clinical studies. J Pain. 2011; 12(2): 157-66.
15. Lautenbacher S. Experimental approaches in the study of pain in the elderly. Pain Med. 2012; 13 Suppl 2: S44-50.
16. Kemp J, Després O, Pebayle T, Dufour A. Age-related decrease in sensitivity to electrical stimulation is unrelated to skin conductance: an evoked potentials study. Clin Neurophysiol. 2014a;125(3): 602-27.
17. Cole LJ, Farrell MJ, Gibson SJ, Egan GF. Age-related differences in pain sensitivity and regional brain activity evoked by noxious pressure. Neurobiol Aging. 2010; 31(3): 494-503.
18. Kemp J, Després O, Pebayle T, Dufour A. Differences in age-related effects on myelinated and unmyelinated peripheral fibres: a sensitivity and evoked potentials study. Eur J Pain. 2014 b;18(4): 482-8.
19. Riley JL 3rd, Cruz-Almeida Y, Glover TL, King CD, Goodin BR, Sibille KT, Bartley EJ, Herbert MS, Sotolongo A, Fessler BJ, Redden DT, Staud R, Bradley LA, Fillingim RB. Age and race effects on pain sensitivity and modulation among middle-aged and older adults. J Pain. 2014; 15(3): 272-82.
20. Blyth FM, Rochat S, Cumming RG, Creasey H, Handelsman DJ, Le Couteur DG, Naganathan V, Sambrook PN, Seibel MJ, Waite LM. Pain, frailty and comorbidity on older men: the CHAMP study. Pain. 2008; 140(1): 224-30.
21. Riley JL 3rd, King CD, Wong F, Fillingim RB, Mauderli AP.Lack of endogenous modulation and reduced decay of prolonged heat pain in older adults. Pain. 2010; 150(1): 153-60.
22. Edwards RR, Fillingim RB, Ness TJ. Age-related differences in endogenous pain modulation: a comparison of diffuse noxious inhibitory controls in healthy older and younger adults. Pain. 2003; 101(1-2):155-65.
23. Arneric SP, Laird JM, Chappell AS, Kennedy JD.Tailoring chronic pain treatments for the elderly: are we prepared for the challenge? Drug Discov Today. 2014; 19(1): 8-17.
24. Thurman R, ed. The Pain Chronicles. 2010; 5–6, Farrar Straus, and Giroux, New York, NY
25. Tsuboi I, Harada T, Hirabayashi Y, Kanno J, Inoue T, Aizawa S. Age-related decline of mast cell regeneration in senescence-accelerated mice (SAMP1) after chemical myeloablation due to senescent stromal cell impairment. Exp Biol Med (Maywood). 2012; 237(11):1289-97.
26. Grizzi F, Di Caro G, Laghi L, Hermonat P, Mazzola P, Nguyen DD, Radhi S, Figueroa JA, Cobos E, Annoni G, Chiriva-Internati M. Mast cells and the liver aging process. Immun Ageing. 2013;10(1): 9.
27. Nguyen M, Pace AJ, Koller BH. Age-induced reprogramming of mast cell degranulation. J Immunol. 2005; 175(9): 5701-7.
28. Luo Y, Toyoda M, Nakamura M, Morohashi M. Morphological analysis of skin in senescence-accelerated mouse P10. Med Electron Microsc. 2002; 35(1): 31-45.
29. Gunin AG, Kornilova NK, Vasilieva OV, Petrov VV. Age-related changes in proliferation, the numbers of mast cells, eosinophils, and cd45-positive cells in human dermis. J Gerontol A Biol Sci Med Sci. 2011; 66(4): 385-92.
30. Eggen BJ, Raj D, Hanisch UK, Boddeke HW. Microglial phenotype and adaptation. J Neuroimmune Pharmacol. 2013; 8(4): 807-23.
31. Boche D, Perry VH, Nicoll JA. Review: activation patterns of microglia and their identification in the human brain. Neuropathol Appl Neurobiol. 2013; 39(1): 3-18.
32. Norden DM, Godbout JP. Review: Microglia of the aged brain: primed to be activated and resistant to regulation. Neuropathol Appl Neurobiol. 2013; 39(1):19-34.
33. Sparkman NL, Johnson RW. Neuroinflammation associated with aging sensitizes the brain to the effects of infection or stress. Neuroimmunomodulation. 2008; 15(4-6): 323-30.
34. Xie F, Zhang JC, Fu H, Chen J. Age-related decline of myelin proteins is highly correlated with activation of astrocytes and microglia in the rat CNS. Int J Mol Med. 2013; 32(5): 1021-28.
35. Michaud M, Balardy L, Moulis G, Gaudin C, Peyrot C, Vellas B, Cesari M, Nourhashemi F. Proinflammatory cytokines, aging, and age-related diseases. J Am Med Dir Assoc. 2013; 14(12): 877-82.
36. Berghella AM, Contasta I, Marulli G, D’Innocenzo C, Garofalo F, Gizzi F, Bartolomucci M, Laglia G, Valeri M, Gizzi M, Friscioni M, Barone M, Del Beato T, Secinaro E, Pellegrini P. Ageing gender-specific “Biomarkers of Homeostasis”, to protect ourselves against the diseases of the old age. Immun Ageing. 2014; 11(1): 3.
37. Stowe RP, Peek MK, Cutchin MP, Goodwin JS. Plasma cytokine levels in a population-based study: relation to age and ethnicity. J Gerontol A Biol Sci Med Sci. 2010; 65(4): 429-33.
38. Zakoscielna KM, Parmelee PA. Pain variability and its predictors in older adults: depression, cognition, functional status, health, and pain. J Aging Health. 2013; 25(8): 1329-39.
39. Costardi D, Rozzini L, Costanzi C, Ghianda D, Franzoni S, Padovani A, Trabucchi M. The Italian version of the pain assessment in advanced dementia (PAINAD) scale. Arch Gerontol Geriatr. 2007; 44(2): 175-80.
40. Gallini A, Gardette V, Vellas B, Lapeyre-Mestre M, Andrieu S, Brefel-Courbon C; REAL.FR/DSA group. Persistent use of analgesic medications in mild-to-moderate Alzheimer’s disease. Drugs Aging. 2013; 30(6): 439-45.
41. Liu MG, Chen J.Preclinical research on pain comorbidity with affective disorders and cognitive deficits: Challenges and perspectives. Prog Neurobiol. 2014; 116:13-32.
42. Leadley RM, Armstrong N, Reid KJ, Allen A, Misso KV, Kleijnen J. Healthy Aging in Relation to Chronic Pain and Quality of Life in Europe. Pain Pract. 2013. doi: 10.1111/papr.12125.
43. Mackin RS, Nelson JC, Delucchi KL, Raue PJ, Satre DD, Kiosses DN, Alexopoulos GS, Arean PA. Association of Age at Depression Onset with Cognitive Functioning in Individuals with Late-Life Depression and Executive Dysfunction. Am J Geriatr Psychiatry. 2014. pii: S1064-7481(14)00076-1. doi: 10.1016/j.jagp.2014.02.006.
44. Modig S, Midlöv P, Kristensson J. Depressive symptoms among frail elderly in ordinary living: who is affected and who is treated? Aging Ment Health. 2014. In Press.
45. Chen Q, Hayman LL, Shmerling RH, Bean JF, Leveille SG. Characteristics of chronic pain associated with sleep difficulty in older adults: the Maintenance of Balance, Independent Living, Intellect, and Zest in the Elderly (MOBILIZE) Boston study. J Am Geriatr Soc. 2011; 59(8):1385-92.
46. Artner J, Cakir B, Spiekermann JA, Kurz S, Leucht F, Reichel H, Lattig F. Prevalence of sleep deprivation in patients with chronic neck and back pain: a retrospective evaluation of 1016 patients. J Pain Res. 2013; 6: 1-6.
47. Moore AJ, Richardson JC, Sim J, Bernard M, Jordan KP. Older People’s Perceptions of Remaining Physically Active and Living With Chronic Pain. Qual Health Res. 2014. In Press.
48. Abdulla A, Adams N, Bone M, Elliott AM, Gaffin J, Jones D, Knaggs R, Martin D, Sampson L, Schofield P; British Geriatric Society. Guidance on the management of pain in older people. Age Ageing. 2013; 42 Suppl 1:i1-57.
49. Sheen CH, Schleimer RP, Kulka M. Codeine induces human mast cell chemokine and cytokine production: involvement of G-protein activation. Allergy. 2007;62(5):532-8.
50. Eidson LN, Murphy AZ. Blockade of Toll-like receptor 4 attenuates morphine tolerance and facilitates the pain relieving properties of morphine. J Neurosci. 2013; 33(40):15952-63.
51. Merighi S, Gessi S, Varani K, Fazzi D, Stefanelli A, Borea PA. Morphine mediates a proinflammatory phenotype via μ-opioid receptor-PKCɛ-Akt-ERK1/2 signaling pathway in activated microglial cells. Biochem Pharmacol. 2013; 86(4): 487-96.
52. Skaper SD, Facci L, Fusco M, Della Valle MF, Zusso M, Costa B, Giusti P. Palmitoylethanolamide, a naturally occurring disease-modifying agent in neuropathic pain. Inflammopharmacology. 2014; 22(2): 79-94.
53. Hansen HS. Palmitoylethanolamide and other anandamide congeners. Proposed role in the diseased brain. Exp Neurol. 2010; 224(1): 48-55.
54. Petrosino S, Iuvone T, Di Marzo V. N-palmitoyl-ethanolamine: Biochemistry and new therapeutic opportunities. Biochimie 2010; 92: 724-727.
55. Skaper SD, Facci L. Mast cell-glia axis in neuroinflammation and therapeutic potential of the anandamide congener palmitoylethanolamide. Philos Trans R Soc Lond B Biol Sci. 2012; 367(1607): 3312-25.
56. Mazzari S, Canella R, Petrelli L, Marcolongo G, Leon L. N-(2-hydroxyethyl)hexadecanamide is orally active in reducing edema formation and inflammatory hyperalgesia by downmodulating mast cell activation. Eur J Pharmacol 199; 6300: 227-236.
57. Calignano A, La Rana G, Giuffrida A, Piomelli D. Control of pain initiation by endogenous cannabinoids. Nature 1998; 394: 277-281.
58. Jaggar SI, Hasnie FS, Sellaturay S, Rice SA. The anti-hyperalgesic actions of the cannabinoid anandamide and the putative CB2 receptor agonist palmitoylethanolamide in visceral and somatic inflammatory pain. Pain 1998; 76:189-199.
59. Romero TR, Duarte ID. N-palmitoyl-ethanolamine (PEA) induces peripheral antinociceptive effect by ATP-sensitive K+-channel activation. J Pharmacol Sci. 2012; 118(2): 156-60.
60. Romero TR, Galdino GS, Silva GC, Resende LC, Perez AC, Cortes SF, Duarte ID. Involvement of the L-arginine/nitric oxide/cyclic guanosine monophosphate pathway in peripheral antinociception induced by N-palmitoyl-ethanolamine in rats. J Neurosci Res. 2012; 90(7): 1474-9.
61. Romero TR, Resende LC, Guzzo LS, Duarte ID.CB1 and CB2 cannabinoid receptor agonists induce peripheral antinociception by activation of the endogenous noradrenergic system. Anesth Analg. 2013; 116(2): 463-72.
62. de Filippis D, Luongo L, Cipriano M, Palazzo E, Cinelli MP, de Novellis V, Maione S, Iuvone T. Palmitoylethanolamide reduces granuloma-induced hyperalgesia by modulation of mast cell activation in rats. Mol Pain 2011; 10:3.
63. Helyes Z, Németh J, Thán M, Bölcskei K, Pintér E, Szolcsányi J. Inhibitory effect of anandamide on resiniferatoxininduced sensory neuropeptide release in vivo and neuropathic hyperalgesia in the rat. Life Sci 2003;7 3: 2345–53.
64. Costa B, Comelli F, Bettoni I, Colleoni M, Giagnoni G. The endogenous fatty acid amide, palmitoylethanolamide, has anti-allodynic and anti-hyperalgesic effects in a murine model of neuropathic pain: involvement of CB(1), TRPV1 and PPARgamma receptors and neurotrophic factors. Pain. 2008; 139(3): 541-50.
65. Luongo L, Guida F, Boccella S, Bellini G, Gatta L, Rossi F, de Novellis V, Maione S. Palmitoylethanolamide reduces formalin-induced neuropathic-like behaviour through spinal glial/microglial phenotypical changes in mice. CNS Neurol Disord Drug Targets. 2013; 12(1): 45-54.
66. Bettoni I, Comelli F, Colombo A, Bonfanti P, Costa B. Non-neuronal cell modulation relieves neuropathic pain: efficacy of the endogenous lipid palmitoylethanolamide. CNS Neurol Disord Drug Targets. 2013; 12(1): 34-44.
67. Di Cesare Mannelli L, D’Agostino G, Pacini A, Russo R, Zanardelli M . Palmitoylethanolamide is a disease-modifying agent in peripheral neuropathy: pain relief and neuroprotection share a PPAR-alpha-mediated mechanism. Mediators Inflamm. 2013;2013:328797.
68. Guida G, de Fabiani A, Lanaia F, Alexandre A, Vassallo GM, Cantieri L, de Martino M, Rogai M, Petrosino S. La palmitoiletanolamida (Normast®) en el dolor neuropático crónico por lumbociatalgia de tipo compresivo: estudio clínico multicéntrico. Dolor. 2010; 25: 35-42.
69. Desio P, Bonadiman L, Fusco M, Cenacchi T. Combination of carbamazepine and palmitoylethanolamide for trigminal neuralgia. PeriMed 2010; 4:4.
70. Desio P. Associazione dell’ossicodone a lenta titolazione con Palmitoiletanolamide per il trattamento del low back pain. Anestesia e Medicina critica (AMC). 2011; 1(2):62-71
71. Conigliaro R, Drago V, Foster PS,. Schievano C, Di Marzo V. Use of the Palmitoylethanolamide in the Entrapment Neuropathy of the Median in the Wrist. Minerva Medica. 2011; 102(2): 141-7.
72. Bacci C, Cassetta G, Emanuele B, Berengo M. Randomized split-mouth study on postoperative effects of palmitoylethanolamide for impacted lower third molar surgery. ISRN Surg. 2011;2011:917350.
73. Marini I, Bartolucci ML, Bortolotti F, Gatto MR, Bonetti GA. Palmitoylethanolamide versus a nonsteroidal anti-inflammatory drug in the treatment of temporomandibular joint inflammatory pain. J Orofac Pain. 2012 Spring; 26(2): 99-104.
74. Canteri L, Petrosino S, Guida G. Riduzione del consumo di antinfiammatori e analgesici nella terapia del dolore neuropático cronico in pazienti affetti da lombosciatalgia di tipo compressivo e in trattamento con NORMAST® 300 mg. Dolor 2010;25: 227-234.
75. Truini A, Biasiotta A, Di Stefano G, Cesa SL, Leone C, Cartoni C, Federico V, Petrucci MT, Cruccu G. Palmitoylethanolamide Restores Myelinated-Fibre Function in Patients with Chemotherapy-Induced Painful Neuropathy. CNS Neurol Disord Drug Targets. 2011; 10(8): 916-20.
76. Assini A, Laricchia D, Belletti M, Pandolfini L, Pizzo R, Ratto S. The carpal tunnel syndrome in diabetes: clinical and electrophysiological improvement after treatment with palmitoylethanolamide. Eur J Neurol. 2010;17: 295.
77. Gatti A, Lazzari M, Gianfelice V, Di Paolo A, Sabato E, Sabato AF. Palmitoylethanolamide in the treatment of chronic pain caused by different etiopathogeneses. Pain Med. 2012; 13(9): 1121-30.
78. Desio P. Associazione dell’ossicodone a lenta titolazione con Palmitoiletanolamide per il trattamento del low back pain. Anestesia e Medicina critica (AMC). 2011; 1(2): 62-71.
79. Esposito E, Cuzzocrea S. Palmitoylethanolamide is a new possible pharmacological treatment for the inflammation associated with trauma. Mini Rev Med Chem. 2013; 13(2): 237-55.
80. Yu HL, Deng XQ, Li YJ, Li YC, Quan ZS, Sun XY. N-palmitoylethanolamide, an endocannabinoid, exhibits antidepressant effects in the forced swim test and the tail suspension test in mice. Pharmacol Rep. 2011; 63(3): 834-9.
81. Crupi R, Paterniti I, Ahmad A, Campolo M, Esposito E, Cuzzocrea S. Effects of palmitoylethanolamide and luteolin in an animal model of anxiety/depression. CNS Neurol Disord Drug Targets. 2013; 12(7): 989-1001.
82. He W, Muenchrath MN. 90+ in the United States: 2006–2008. American Community Survey Reports, ACS-17. http://www.census.gov/prod/2011pubs/acs-17.pdf
83. Rechel B, Grundy E, Robine JM, Cylus J, Mackenbach JP, Knai C, McKee M. Ageing in the European Union. Lancet. 2013; 381(9874): 1312-22.
84. Desio P. Associazione tra pregabalin e palmitoiletanolamide per il trattamento del dolore neuropatico. Pathos 2010; 7(4): 9-14.
85. Calabrò RS, Gervasi G, Marino S, Mondo PN, Bramanti P. Misdiagnosed chronic pelvic pain: pudendal neuralgia responding to a novel use of palmitoylethanolamide. Pain Med 2010; 11: 781–784.
86. Calabrò RS, Bramanti P. Occipital neuralgia responding to palmitoylethanolamide. Headache. 2013 doi:10.1111/head.12136.
87. Russo G, Parabita M. Decrease of spasticity and pain after stroke due to treatment with PEA. 14th congress European Shock Soc, Taormina, Italy 2011.
88. Indraccolo U, Barbieri F. Effect of palmitoylethanolamide-polydatin combination on chronic pelvic pain associated with endometriosis: preliminary observations. Eur J Obstet Gynecol Reprod Biol 2010; 150: 76-79.
89. Cobellis L, Castaldi MA, Giordano V, Trabucco E, De Franciscis P, Torella M, Colacurci N. Effectiveness of the association micronized N-Palmitoylethanolamine (PEA)-transpolydatin in the treatment of chronic pelvic pain related to endometriosis after laparoscopic assessment: a pilot study. Eur J Obstet Gynecol Reprod Biol 2011; 158: 82-86.
90. Giugliano E, Cagnazzo E, Soave I, Lo Monte G, Wenger JM, Marci R. The adjuvant use of N-palmitoylethanolamine and transpolydatin in the treatment of endometriotic pain. Eur J Obstet Gynecol Reprod Biol. 2013; 168(2): 209-13.
91. Fulghesu A, Magnini R, Mazzella S, Cappai A, Orrù A, Pisu M. Treatment of adolescent dysmenorrhea by a new inhibitor of mast cells-induced inflammation (palmitoiletanolamide? trans polidatina) 16° Pediatric and Adolescent Gynecology Congress-Montpellier (France), 22–25 maggio 2010.
92. Domínguez CM, Martín A, Ferrer FG, Puertas MAI , Muro AL, González JCM, Prieto JP Taberna IR. N-palmitoylethanolamide in the treatment of neuropathic pain associated with lumbosciatica Pain Manage. 2012; 2(2): 119–124.
93. Schifilliti C, Cucinotta L, Fedele V, Ingegnosi C, Luca S, Leotta C. Micronized palmitoylethanolamide reduces the symptoms of neuropathic pain in diabetic patients. Pain Res Treat. 2014; 2014: 849623.
94. Cocito D, Peci E, Ciaramitaro P, Merola A, Lopiano L. Short-term efficacy of ultramicronized palmitoylethanolamide in peripheral neuropathic pain. Pain Res Treat. 2014;2014:854560.
95. Impellizzeri D, Bruschetta G, Cordaro M, Crupi R, Siracusa R, Esposito E, Cuzzocrea S. Micronized/ultramicronized palmitoylethanolamide displays superior oral efficacy compared to nonmicronized palmitoylethanolamide in a rat model of inflammatory pain. J Neuroinflammation. 2014; 11(1): 136.
96. Cerrato S, Brazis P, Della Valle MF, Miolo A, Petrosino S, Di Marzo V, Puigdemont A. Effects of palmitoylethanolamide on the cutaneous allergic inflammatory response in Ascaris hypersensitive Beagle dogs. Vet J. 2012; 191(3): 377-82.
97. Petrosino S, Brazil P, Puigdemont A, Fusco M, Comelli F, Costa B, Di Marzo V. Possible “entourage” effect of palmitoylethanolamide in dog and human plasma. 20th Annual Symposium on the Cannabinoids, International Cannabinoid Research Society, Research Triangle Park, NC, USA, 2010 P3-4.