Introduzione
Negli ultimi cinquant’anni l’invecchiamento della popolazione italiana è stato uno dei più rapidi tra i Paesi sviluppati e si stima che nel 2050 gli ultrasessantacinquenni rappresenteranno il 35,9% della popolazione totale, con un’attesa di vita media pari a 82,5 anni (79,5 per gli uomini e 85,6 per le donne) (1). Tra le patologie croniche degenerative a carico della popolazione anziana, il deterioramento cognitivo rappresenta uno dei maggiori problemi di salute pubblica. Le persone con demenza sono maggiormente vulnerabili al dolore, infatti, con l’aumentare del declino cognitivo diminuisce la capacità di utilizzare il self-report, considerato ancora il gold standard per la valutazione del dolore (2-4). La prevalenza della demenza nella popolazione anziana a domicilio è stimata tra il 5,9% e l’8,3%, e tale percentuale sale fino al 36% se si tratta di anziani residenti nelle case di riposo (4).
La mancata identificazione del dolore nel paziente anziano con deficit cognitivo ha importanti ricadute sullo stato di salute e sulla qualità della vita (5). Diviene quindi fondamentale ricercare delle manifestazioni non-verbali di dolore, affinché queste possano essere precocemente riconosciute e interpretate, al fine di evitare gravi conseguenze quali: ansia, agitazione, astenia, peggioramento della funzionalità cognitiva e motoria, alterazione del sonno, isolamento sociale e, di conseguenza, aumento delle cure sanitarie e dei costi (5). Pur essendo riportati in letteratura diversi strumenti per valutare il dolore in questa tipologia di pazienti, un quesito resta ancora oggi senza risposta: il dolore acuto e quello cronico richiedono diverse strategie di valutazione comportamentali se il deficit cognitivo è presente (6)?
Per rispondere a questa domanda occorre considerare gli indicatori individuati dall’American Geriatrics Society nel 2002 (2), dove la valutazione del dolore nei pazienti non verbalizzanti con deterioramento cognitivo si ottiene osservando le espressioni facciali, le verbalizzazioni o vocalizzazioni, i movimenti del corpo, i cambiamenti nelle interazioni interpersonali, i cambiamenti nei modelli di attività e nelle abitudini e i cambiamenti nello status mentale. Anche l’Australian Pain Society nel 2005 (3) ha pubblicato le raccomandazioni sulla valutazione del dolore dei pazienti anziani con deficit cognitivi, indicando che la valutazione si differenzia in base al grado di deterioramento cognitivo. Tuttavia, allo stato attuale, non vi è ancora uno strumento di valutazione da considerarsi totalmente completo e affidabile, il dolore rimane un fenomeno soggettivo, in cui vissuto precedente, cultura, genere, percezione della salute, rappresentano le variabili che caratterizzano un individuo rispetto ad un altro. Tale difficoltà, associata alla scarsa formazione degli infermieri sulla rilevazione del dolore di questa tipologia di pazienti, conduce a non valutare la sintomatologia con le conseguenze che da tutto questo ne derivano, ovvero sottostima e sotto-trattamento (7). Stabilito quindi che la valutazione del dolore nei pazienti con grave deterioramento cognitivo può risultare dispendiosa in termini di tempo, complessa nonché indispensabile, questo lavoro intende confrontare i vari strumenti presenti in letteratura e validati in lingua italiana, al fine di descriverne le caratteristiche peculiari e l’applicazione in ambito clinico tra i colleghi italiani, e di individuare quale fra questi risulta essere più idoneo e specifico in questa tipologia di pazienti.
Metodi
Le banche dati consultate per la revisione narrativa della letteratura sono state CINAHL, Pubmed e Cochrane attraverso le biblioteche digitali della “Sapienza” Università di Roma e dell’Università degli Studi di Parma, tra marzo 2015 e ottobre 2016. È stata utilizzata la tecnica dello snowballing al fine di limitare la perdita di articoli di interesse all’obiettivo dello studio. La ricerca è stata condotta senza limiti temporali per ampliare la possibilità di recuperare articoli specifici. Il filtro utilizzato è stato age (65+adult), e le query ottenute hanno utilizzato l’operatore booleano “AND”. Gli articoli e i relativi strumenti ottenuti sono stati descritti una sola volta. I criteri d’inclusione sono stati articoli in lingua italiana e inglese, che trattassero di valutazione del dolore in soggetti geriatrici non verbalizzanti, di età superiore ai sessantacinque anni (geriatrici), con deterioramento cognitivo moderato-grave, e articoli che descrivessero le caratteristiche psicometriche di strumenti di valutazione del dolore di tipo comportamentale. I criteri di esclusione sono i seguenti: articoli in altre lingue; strumenti applicabili a popolazione pediatrica, o su adulti, e comunque di età inferiore a 65 anni. Al fine di ottenere una panoramica più ampia sono stati consultati i siti delle associazioni scientifiche Australian Pain Society (APS), American Geriatrics Society (AGS), Associazione Italiana per lo Studio sul Dolore (AISD) e l’Associazione Internazionale per lo Studio del Dolore (IASP). I risultati sono stati sintetizzati attraverso tabelle riassuntive, descrivendone le caratteristiche peculiari, l’applicazione clinica solo su strumenti disponibili e validati in lingua italiana.Risultati
La nostra revisione integrativa della letteratura ha ottenuto diciassette strumenti di valutazione del dolore. Dei diciassette articoli, sette sono stati analizzati in questa ricerca, in quanto validati in lingua italiana. I risultati della revisione sono descritti sinteticamente nel Grafico 1.
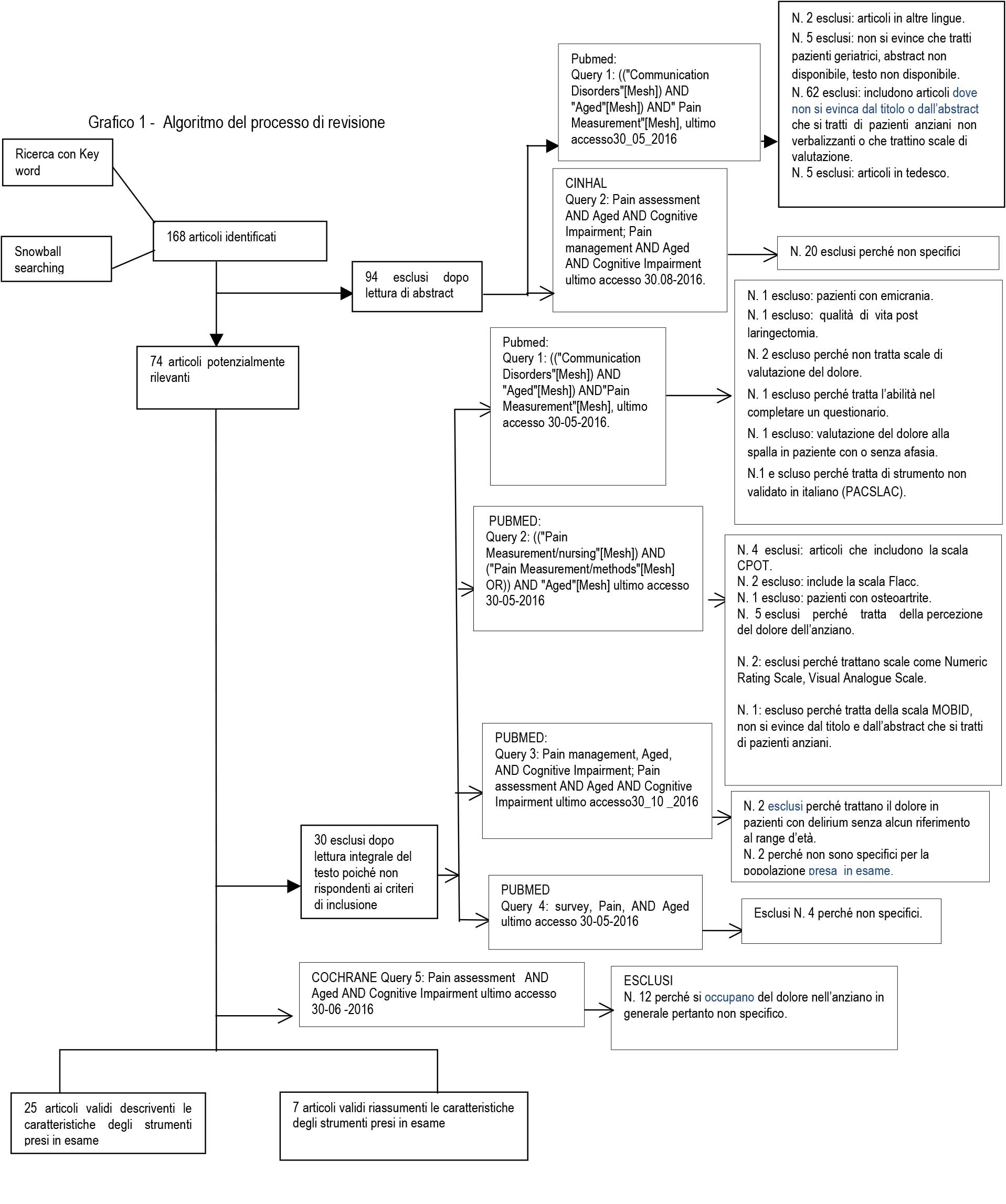
I sette strumenti di valutazione prodotti dalla revisione integrativa della letteratura sono stati riassunti nella Tabella 1: PAINAD (Pain Assessment In Advanced Dementia) Scale (8), Abbey Pain Scale (9) , NOPPAIN (Non Communicative Patient’s Pain Assessment INstrument) Scale (10), Doloplus 2 Scale (11), DS-DAT (Discomfort Scale Dementia of the Alzheimer’s Type) (12), Face Pain Scale Revised (13), FLACC (Face, Legs, Activity, Cry and Consolability Pain Assessment Tool) (14).
Le relative caratteristiche psicometriche e altre specifiche, quali semplicità, facilità di somministrazione e comprensione, durata della rilevazione, arco di tempo necessario per la registrazione e elaborazione dei dati, sono state riepilogate (Tabella 1).
Uno studio di validazione in lingua italiana è presente per ogni strumento individuato: quello di Costardi et al (2004) per PAINAD (16), quello di Storti et al (2009) per Abbey Pain Scale (17), quello di Ferrari et al (2009) per NOPPAIN (18), quello di Pickering et al (2010) per Doloplus (19), quello di Dello Russo et al (2008) per DS- DAT (20) e quello di Von Bayer et al (2003) per FPS- R (21), quello di Faraldo et al (2016) per FLACC revised (14).
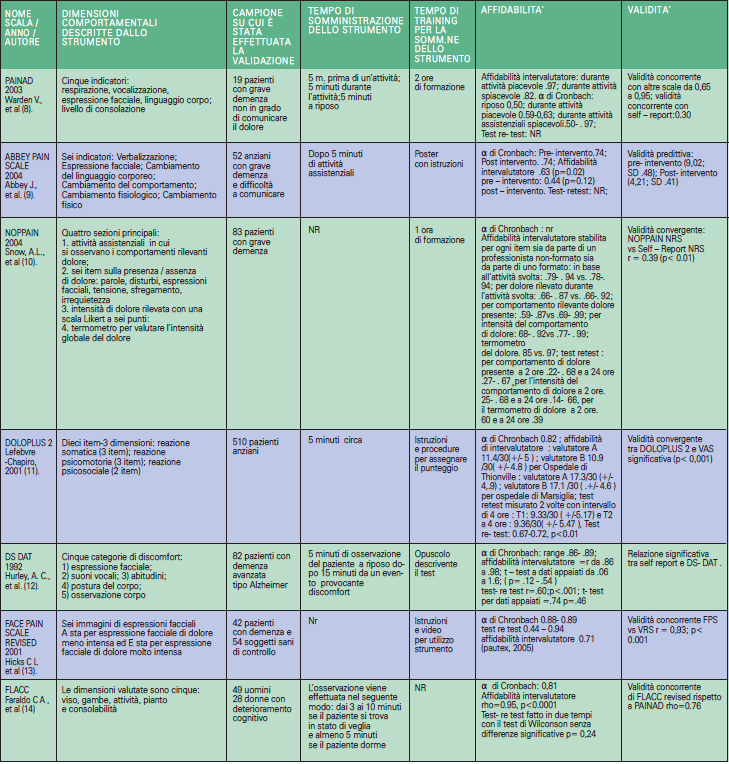
Sono state prese in considerazione le caratteristiche peculiari delle differenti scale:
PAINAD è in grado di rilevare la presenza e l’intensità di dolore in un individuo e non identifica la sintomatologia algica nei pazienti che mostrano comportamenti diversi da quelli inclusi nello strumento (8). Gli indicatori di dolore come i cambiamenti nei modelli di attività, nelle interazioni interpersonali e nelle alterazioni dello stato mentale non sono inclusi (8). Confrontando lo studio originale di Warden et al. (8) e quello di validazione in lingua italiana (13) emerge che nel primo (8) il 100% dei pazienti sono maschi con deterioramento cognitivo, nel secondo (13) l’80% è rappresentato da pazienti donne e solo il 20% da pazienti maschi. Inoltre, mentre dal confronto con Abbey Pain Scale, PAINAD risulta essere meno dispendiosa in termini di tempi di somministrazione (22), il confronto con FLACC Revised rivela ridotta sensibilità e scarsa specificità dello strumento PAINAD riuscendo a rilevare il dolore soltanto in sette persone, anziché in 32 come con FLACC Revised nello stesso studio (22).
Abbey Pain Scale (2004) è uno strumento che permette una valutazione olistica del dolore da parte dell’infermiere (9). L’utilizzo dello strumento è previsto quando l’infermiere sospetta che un paziente abbia dolore (9). Pur prevedendo una valutazione del dolore da parte degli infermieri, non è chiaro cosa faccia sorgere il sospetto della sintomatologia algica nel paziente sofferente. L’expertise e la competenza, di cui il professionista necessita per utilizzare questo strumento, non sono specificate. Dalla revisione integrativa emerge quanto non sia chiaro quale dato sia stato preso in considerazione tra episodio di dolore, punteggio ottenuto o media del punteggio per valutare l’affidabilità e la validità dello strumento. Il confronto tra Abbey Pain Scale e PAINAD ha mostrato quanto L’Abbey Pain Scale sia più dispendiosa in termini di somministrazione: 41+/-25 secondi verso 101+/-39 secondi; p < 0,001 (22). La validità di contenuto e di facciata è stata stabilita tramite focus group tra infermieri, geriatri ed esperti del dolore (9). Il concetto di base dello strumento non è chiaro, andando a inficiare la validità di contenuto dello stesso. Le istruzioni su come utilizzare lo strumento sono carenti e alcuni dati a riguardo sono stati pubblicati su un poster (23).
NOPPAIN (2004) è uno strumento che consente di individuare solo i comportamenti tipici di dolore, pur non essendo chiara la correlazione con l’intensità della sintomatologia algica (10). Così facendo si incorre nella possibilità di classificare un paziente quale avente dolore quando in realtà non lo prova. Inoltre l’utilizzo dello strumento implica la registrazione e codificazione dei comportamenti tipici di dolore del paziente con deterioramento cognitivo attraverso un video, per far si che l’infermiere sia in grado di identificare l’intensità del dolore provato dal paziente in un contesto reale. La formazione necessaria affinché la somministrazione di tale strumento risulti accurata è poco chiara. Tale problematica è ancor più importante data la difficile interpretazione dell’intensità di dolore attribuibile al comportamento tipico individuato e valutato da parte del professionista sanitario (27).
Doloplus 2 (2001) è uno strumento che non descrive il singolo episodio doloroso ma riflette il decorso del dolore in un periodo prolungato, richiedendo una buona conoscenza del paziente da parte del professionista sanitario (11). La validazione in lingua italiana dello studio prevede l’utilizzo dello strumento in pazienti con deterioramento cognitivo non agitati, senza dolore acuto grave e conosciuti dai professionisti che li assistono al momento della valutazione. L’utilizzo dello strumento Doloplus 2 implica una conoscenza approfondita del paziente da parte dell’infermiere e questo può essere considerato un limite qualora tale conoscenza non sia possibile. Lo strumento è stato ideato per essere somministrato sia da parte del professionista sanitario, sia dal familiare, sia dal caregiver. Al fine di una somministrazione adeguata occorre una formazione specifica, anche se non è stato descritto come debba essere effettuata (23).
DS- DAT (1992) è uno strumento il cui focus non è il dolore ma il discomfort. Il dolore provoca discomfort ma il discomfort non sottace un’espressione di dolore (12). Gli indicatori rilevanti il discomfort nei pazienti con deterioramento cognitivo, in base a quanto ipotizzato dai ricercatori che hanno sviluppato lo strumento, sono simili agli indicatori rilevanti discomfort nei bambini. DS DAT misura la frequenza, l’intensità e la durata del discomfort. Lo strumento risulta essere complesso sia nella somministrazione che nella rilevazione del punteggio ottenuto, tanto da richiedere un’ampia formazione. Tale complessità ne limita l’utilizzo a livello clinico.
Face Pain Scale Revised (FPS-R) (2001) è uno strumento che consente di valutare l’espressione facciale del paziente con deterioramento cognitivo (13). Al fine di evitare di misurare altro rispetto al dolore quali: ansia, depressione, aggressività, insoddisfazione, sono state codificate le espressioni facciali confrontando pazienti sani rispetto ai pazienti con deterioramento cognitivo (24). Lo strumento, utilizzato inizialmente per i bambini (13), si rivela valido e affidabile in pazienti con deterioramento cognitivo dal momento che è stato dimostrato quanto la frequenza e l’intensità delle sensazioni dolorose nei pazienti con deterioramento cognitivo abbiano un effetto significativo (26). Inoltre, confrontando l’intensità del dolore nei pazienti con deterioramento cognitivo rispetto ai pazienti sani, l’espressione facciale è stata più accentuata nei primi (26). Purtuttavia, come si evince dalla letteratura, con FPS-R, a causa della sua natura astratta e della sua scarsa affidabilità, è possibile incorrere in interpretazioni errate di dolore in pazienti con deterioramento cognitivo (25).
FLACC inizialmente è stato validato per la valutazione del dolore nei bambini (26), ma nel 2002 un poster pubblicato da Baiardi et al riportava la somministrazione dello strumento a sei pazienti con deterioramento cognitivo (15). La scarsa numerosità del campione ha condotto a considerare tale studio non valido ai fini della valutazione dello stesso. È del 2016 lo studio di Faraldo et al che riporta le caratteristiche dello strumento e ne valuta la fattibilità in pazienti con deterioramento cognitivo, mettendolo a confronto con PAINAD (14). Le caratteristiche riscontrate e accertate di questo strumento fanno sì che si possa ipotizzare che sia il più indicato in questa tipologia di pazienti (14).
Al fine di una dettagliata descrizione delle caratteristiche degli strumenti presi in considerazione, sono stati elencati e riassunti gli item di cui sono composti, così come riportato nella Tabella 2, confrontandoli con quelli enunciati dall’American Geriatric Society (2002), per sottolineare quanto questa nostra ipotesi possa essere presa in considerazione (2).
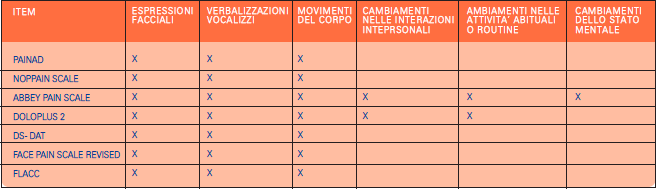
Dal confronto degli item emerge che:
PAINAD consiste di cinque item con tre modalità di risposta da 0 a 2 e punteggio totale massimo di 10. Gradi crescenti di dolore riflettono aumentati livelli. La misurazione dell’intensità del dolore è indiretta, poiché, essendo una scala osservazionale, si assume per vero che un dato comportamento rifletta il dolore del paziente non in grado di riferirlo. Delle cinque categorie comportamentali relative al dolore, il respiro può portare a individuare casi d’infezione respiratoria e polmonite quali cause di morte, mentre la consolabilità è considerata una risposta a un intervento. Questi item, pur presenti all’interno dello strumento, risultano essere poco specifici, anche se rimuovendoli si rischia di inficiare l’affidabilità dello stesso. NOPPAIN è suddiviso in quattro sezioni, nella prima sezione viene chiesto all’infermiere quali prestazioni siano state eseguite e se fosse presente il dolore al momento dell’esecuzione del test; nella seconda sezione sono presentati sei comportamenti del paziente che fanno rilevare la presenza e l’intensità del dolore da lui provato su una scala a cinque punti; nella terza sezione il professionista localizza il dolore provato dal paziente; nella quarta l’infermiere valuta l’intensità del dolore globale attraverso una scala con sei descrittori verbali (da nessun dolore a dolore quasi insopportabile). Oltre a determinare i comportamenti tipici rilevanti il dolore, nello strumento è incluso anche un righello per la valutazione globale dell’intensità della sintomatologia. NOPPAIN fornisce informazioni sulla presenza e sull’intensità del dolore, ma non sulla qualità del sintomo algico. Lo strumento, essendo composto da pochi comportamenti rilevanti dolore, è molto specifico ma poco sensibile in quanto non rileva il dolore in quei pazienti che presentano comportamenti meno rappresentativi dello stesso.
Abbey Pain Scale consiste di 6 item con 4 modalità di risposte da 0 a 3 con un range di 0-18. Lo strumento prevede di interpretare se il dolore del paziente è acuto, cronico o acuto su cronico, ma non risultano noti i criteri attraverso i quali tale procedimento dovrebbe essere fatto. La rilevazione del dolore cronico può essere compromessa dall’inclusione degli indicatori fisiologici, quali la rilevazione della temperatura, del polso, della pressione arteriosa, della sudorazione, del pallore e delle vampate di calore. Da quanto emerso dalla revisione integrativa l’attribuzione del punteggio ottenuto con Abbey Pain Scale non è chiara.
Doloplus 2 è suddiviso in tre sottoscale con un totale di 10 item. Ogni item è valutato su una scala a quattro punti da 0 a 3 con un range di 0-30. La soglia che indica presenza di dolore è 5. Le istruzioni indicano che se un item è inadeguato non è rilevato. Da quanto emerso dalla revisione integrativa l’interpretazione del punteggio dello strumento non è chiara, tanto più che non è specificato come gli item non rilevati influenzino il punteggio.
DS- DAT è composto da 9 item che valutano il discomfort e non la presenza e l’intensità del dolore. Ogni comportamento viene valutato in base alla frequenza in cinque minuti di osservazione, intensità e durata. Il punteggio totale va da 0 a 27. Il punteggio maggiore rilevato corrisponde al livello più alto di dolore/discomfort. Sia il metodo di somministrazione che l’attribuzione del punteggio risultano essere complessi da applicare.
Face Pain Scale Revised è composto da 6 immagini raffiguranti delle espressioni facciali, su cui il paziente con dolore punta il dito, con un range da 0 a 10. Le immagini riflettono ciò che il paziente prova ovvero 0 equivale a nessun dolore e 10 corrisponde a moltissimo dolore (13). Inizialmente tale scala è stata utilizzata nei bambini e nel 2007 è stato fatto uno studio per valutare quanto il deterioramento cognitivo incida sulla frequenza e l’intensità delle risposte facciali attraverso un sistema di codifica (FACS), dimostrando quanto queste possano essere significative per valutare uno stimolo doloroso in questa tipologia di pazienti (26). FLACC è composto da 5 item valutabili su una scala a tre punti con un range da 0 a 10 dove 7-10 corrisponde a dolore grave.
Alla luce di quanto rilevato, si rileva la semplicità di PAINAD, la complessità di Abbey Pain Scale, la scarsa sensibilità di NOPPAIN, la scarsa maneggevolezza di Doloplus 2, la scarsa specificità di DS-DAT, il diffuso utilizzo nella pratica clinica di Face Pain Scale, la completezza e la fattibilità di FLACC per questa tipologia di pazienti. Oltre alla capacità di rilevare la presenza, l’intensità e la qualità del dolore provato dal paziente, si devono tener presenti la monodimensionalità e la multidimensionalità degli strumenti presi in considerazione (Tabella 3).
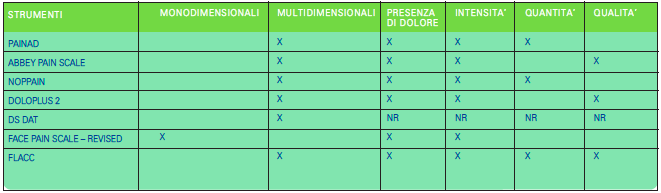
Uno strumento si definisce monodimensionale quando misura esclusivamente un concetto come l’intensità del dolore basandosi sulla descrizione verbale e analogica che la persona riesce a dare attuando una misurazione diretta, mentre uno strumento è multidimensionale quando, oltre a valutare l’intensità del dolore, riesce a individuare specifici indici comportamentali e fisiologici attraverso l’osservazione della persona da parte di un professionista sanitario, o da un caregiver, in base alla complessità dello strumento stesso.
In genere si tratta di strumenti che valutano paritetici indicatori e mentre alcuni si basano principalmente sull’osservazione dei comportamenti, altri si incentrano sull’ascolto del caregiver. Gli strumenti che si basano sull’ascolto del caregiver sono Abbey Pain Scale, FLACC, Doloplus 2. L’osservazione dei comportamenti si ottiene con strumenti come PAINAD, NOPPAIN, Face Pain Scale Revised. Per quanto riguarda DS- DAT non è chiaro se si basa sull’osservazione dei comportamenti rilevanti discomfort anziché dolore, o se si basa sull’ascolto da parte del caregiver. Le difficoltà di comunicazione riscontrabili in pazienti anziani con deterioramento cognitivo sono elementi che il personale infermieristico deve essere in grado di affrontare, al fine di tutelare il diritto a non soffrire e a tutelare la stessa salute. Un altro passo importante per ottenere questo importantissimo traguardo è riuscire a differenziare gli strumenti in base al tipo di dolore rilevato.
Dalla Tabella 4 emerge che, mentre alcuni strumenti sono più indicati nel rilevare il dolore acuto, altri lo sono per il dolore cronico. La revisione integrativa pone in risalto l’importanza di valutare il dolore in questa tipologia di pazienti e sottolinea la rilevanza della formazione dei professionisti sanitari in tale ambito affinché possano essere in grado di scegliere ed utilizzare lo strumento più appropriato.
Tabella 4 – Differenziazione degli strumenti in base al tipo di dolore rilevabile
| DOLORE ACUTO | DOLORE CRONICO |
|---|---|
| PAINAD | DOLOPLUS 2 |
| ABBEY PAIN SCALE | NOPPAIN |
| FACE PAIN SCALE REVISED | DS- DAT |
| FLACC |
Discussione
I sette strumenti individuati dalla revisione integrativa sono stati messi a confronto prendendo in rassegna le caratteristiche psicometriche di ognuno e in principale modo la validità e l’affidabilità. Gli strumenti ottenuti sono pertanto risultati essere dotati di buona validità e affidabilità. Tra le caratteristiche psicometriche, la validità si riferisce alla capacità dello strumento di effettuare la misurazione in maniera accurata e specifica, e di misurare uno specifico fenomeno e nessun altro, mentre l’affidabilità è rappresentata dalla capacità dello stesso di fornire il medesimo risultato nelle misurazioni successive, anche al variare dell’operatore (27). Tali condizioni o caratteristiche psicometriche sono necessarie affinché non si corra il rischio di sottostimare o sovrastimare un fenomeno, oppure di effettuare una misurazione non necessaria alla pratica clinica, con risvolti negativi per la salute dei nostri assistiti (28).
La valutazione dell’intensità del dolore acuto a riposo dopo un intervento chirurgico è frequente in questa popolazione a rischio, non in grado di verbalizzare il dolore. Tuttavia, un adeguato sollievo del dolore durante la mobilizzazione, la respirazione profonda, o la tosse è fondamentale per ridurre i rischi cardiopolmonari e le complicazioni tromboemboliche dopo l’intervento. Inoltre l’immobilizzazione è anche un noto fattore di rischio per il dolore cronico, l’iperalgesia dopo l’intervento chirurgico (29). Rilevare il dolore in pazienti non in grado di comunicarlo pone i professionisti nella possibilità di misurare altro rispetto al dolore. A tal proposito, così come riportato in letteratura (30), è opportuno valutare l’affidabilità, la validità e l’utilizzo nella pratica clinica in un ampio campione e in diversi setting. Ciò che emerge dalla revisione integrativa è che le caratteristiche ricercate sono riscontrabili nello strumento FLACC, pur essendo PAINAD raccomandata dal National Nursing Home Pain Collaborative (31), perché per le caratteristiche riscontrate, risulta essere completo, valido e affidabile. Inoltre, significativa è la rappresentatività delle espressioni facciali nel rilevare il dolore in questa tipologia di pazienti e specifico è tale indicatore così come individuato dallo strumento FLACC, rilevando una sensibilità e una specificità nell’identificare e valutare lo stimolo doloroso (32) (Tabella 5).
Il confronto tra i vari strumenti rispetto all’indicatore espressione facciale e rispetto a quanto rilevato dal sistema di codifica delle azioni facciali, quali abbassamento della fronte, orbita stretta, innalzamento del labbro superiore e apertura della bocca con l’interessamento di muscoli quali elevatore, orbicolare e corrugatore, porta a considerare la specificità nel rilevare la sensazione dolorosa da parte dello strumento FLACC, caratteristica peraltro dimostrata dallo studio di Faraldo et al (14).
Conclusioni
Questo studio evidenzia il panorama italiano di scale di valutazione specifiche per i soggetti geriatrici con deficit cognitivo. Sono sicuramente necessari altri sforzi da parte della ricerca italiana al fine di valutare l’affidabilità, la validità e l’applicabilità di uno strumento come il FLACC in una popolazione fragile come quella di coloro che non sono in grado autonomamente di fare valere il proprio diritto a non soffrire, tanto quanto chi è in grado di verbalizzare ciò che si prova, a tutela di un diritto fondamentale.
Bibliografia
1. United Nations New York World population ageing: 1950-2050 Department of Economic and Social Affairs Population Division (Internet) 2002 (modificato 2002; consultato 30 maggio 2016); Disponibile all’indirizzo goo.gl/CVmYYP.
2. American Geriatrics Society The management of persistent pain in older persons. J Am Geriatr Soc 2002; 6 suppl 50: s205-24.
3. Australian Pain Society Pain In Residential Aged Care Facilities • Management Strategies (Internet) 2005 (modificato agosto 2005; consultato 30 maggio 2016). Disponibile all’indirizzo www.apsoc.org.au/publications.
4. Marini I, Bortolotti F, Bartolucci ML, Inelmen EM, Gatto MR, Bonetti GA Aging effect on pressure pain thresholds of head and neck muscles. Aging Clin Exp Res 2012; 24(3): 239-244.
5. Inelmen EM, Mosele M, Sergi G, Toffanello ED, Coin A, Manzato E Chronic pain in the elderly with advanced dementia. Are we doing our best for their suffering? Aging Clin Exp Res 2012; 24(3): 207-212.
6. Sharon Kaasalainen PhD R Pain assessment in older adults with dementia: using behavioral observation methods in clinical practice. J Gerontol Nurs 2007; 33(6):6.
7. Pellegatta I, Terzoni S, Lodini R , Destrebecq A Le scale di valutazione del dolore nel paziente demente: revisione della letteratura. Pain Nursing Magazine 2014; 3(2): 48- 53.
8. Warden V, Hurley AC, Volicer L Development and psychometric evaluation of the Pain Assessment in Advanced Dementia (PAINAD) scale. J Am Med Dir Assoc 2003; 4(1): 9-15.
9. Abbey J, Piller N, De Bellis A, Esterman A, Parker D, Giles L, et al The Abbey pain scale: a 1-minute numerical indicator for people with end-stage dementia. Int J Palliat Nurs 2004; 10 (1): 6-13.
10. Snow AL, Weber JB, O’Malley KJ, Cody M, Beck C, Bruera E, et al. NOPPAIN: a nursing assistant-administered pain assessment instrument for use in dementia. Dement Geriatr Cogn Disord 2004; 17 (3): 240-246.
11. Lefebvre-Chapiro S. The Doloplus® 2 scale-evaluating pain in the elderly. Eur J Palliative Care 2001; 8(5): 191-195.
12. Hurley AC, Volicer BJ, Hanrahan PA, Houde S, Volicer L Assessment of discomfort in advanced Alzheimer patients. Res Nurs Health 1992; 15(5): 369-377.
13. Hicks CL, von Baeyer CL, Spafford PA, van Korlaar I, Goodenough B The Faces Pain Scale–Revised: toward a common metric in pediatric pain measurement. Pain 2001; 93(2): 173-183
14. Faraldo C A, Terzoni S, Destrebecq A, Di Bari A La valutazione del dolore nel paziente adulto con diagnosi di disabilità intellettiva Pain Nursing Magazine 2016; 5(1): 17-21
15. Baiardi J, Parzuchowski J, Kosik C, Ames T, Courtney N, & Locklear J. Examination of the reliability of the FLACC pain assessment tool with cognitively impaired elderly 2002. In: Poster session presented at the Annual National Conference of Gerontologic Nurse Practitioners, Chicago, Ill.
16. Costardi D, Rozzini L, Costanzi C, Ghianda D, Franzoni S, Padovani A, et al. The Italian version of the pain assessment in advanced dementia (PAINAD) scale. Arch Gerontol Geriatr 2007;44 (2):175-180.
17. Storti M. La validazione di una scala di accertamento del dolore in pazienti con decadimento cognitivo: la scala Abbey nella versione italiana. Recenti Prog Med 2009;100 (9):405-409.
18. Ferrari R, Martini M, Mondini S, Novello C, Palomba D, Scacco C, et al. Pain assessment in non-communicative patients: the Italian version of the Non-Communicative Patient’s Pain Assessment Instrument (NOPPAIN). Aging Clin Exp Res 2009; 21(4-5): 298-306.
19. Pickering G, Gibson S, Serbouti S, Odetti P, Gonçalves JF, Gambassi G, et al. Reliability study in five languages of the translation of the pain behavioural scale Doloplus®. Eur J Pain 2010; 14(5): 545. e1-545. e10.
20. Dello Russo C, Di Giulio P, Brunelli C, Dimonte V, Villani D, Renga G, et al. Validation of the Italian version of the Discomfort Scale–Dementia of Alzheimer Type. J Adv Nurs 2008; 64(3): 298-304.
21. Von Bayer CL, et al The Face Pain Scale- Revised (FPS- R) around the world: translation and adaptation for use in many cultures. Poster, 6th International Symposiumon Paediatric Pain, Special Interest Group on Pain in Childhood, International Association for the Study of Pain, Sydney, Australia. Also presented to Canadian pain Society, Toronto. Pain Research and Management 2003; 8(suppl. B): 57 B
22. Storti M, Dal Santo P, Zanolin M E Confronto fra due scale di valutazione del dolore in pazienti ospedalizzati affetti da grave demenza e non verbalizzanti Prof Inferm, 61(4): 210-215.
23. Herr K, Bjoro K, & Decker S. Tools for assessment of pain in nonverbal older adults with dementia: a state-of-the-science review. J Pain Symptom Manage 2006; 31(2), 170-192.
24. Kunz M, Scharmann S, Hemmeter U, Schepelmann K, Lautenbacher S. The facial expression of pain in patients with dementia. PAIN 2007; 133(1): 221-228.
25. Herr K, Pain assessment strategies in older patients. J Pain 2011;12(3), S3-S13.
26. Voepel-Lewis T, Shayevitz JR, Malviya S. The FLACC: a behavioral scale for scoring postoperative pain in young children. Pediatr Nurs 1997; 23: 293-297.
27. Lo Biondo G, Haber WJ Metodologia della ricerca infermieristica. Milano: McGraw- Hill, 2004: 480.
28. Breivik H, Borchgrevink PC, Allen S M, Rosseland LA, Romundstad L, Hals E K, et al. Assessment of pain. Br J Anaesth 2008; 101(1): 17-24.
29. Stubhaug A, Breivik H. Prevention and treatment of hyperalgesia and persistent pain after surgery. Pain best practice and research compendium.London: Elsevier 2007: 281-288.
30. Lichtner V, Dowding D, Esterhuizen P, Closs SJ, Long AF, Corbett A, et al. Pain assessment for people with dementia: a systematic review of systematic reviews of pain assessment tools. BMC geriatrics 2014; 14(1): 1.
31. Hadjistavropoulos T, Herr K, Prkachin K M, Craig KD, Gibson SJ, Lukas A, et al. Pain assessment in elderly adults with dementia. Lancet Neurology 2014; 13(12): 1216-1227.
32. Flaherty E. Using pain-rating scales with older adults. Am J Nurs 2008; 108(6): 40-7; quiz 48.
